Download étude hydrochimique de quelques eaux minérales - Infoterre
Transcript
MINISTÈRE DU DÉVELOPPEMENT INDUSTRIEL ET SCIENTIFIQUE
BUREAU DE RECHERCHES GÉOLOGIQUES ET MINIÈRES
SERVICE GÉOLOGIQUE NATIONAL
B.P.
6009
-
45
Orléans (02)
- Tél.:
(38)
66.06.60
ÉTUDE HYDROCHIMIQUE DE QUELQUES EAUX MINÉRALES FRANÇAISES
Applications des méthodes de traitement automatique
par
Melle M. LOUVRIER
Département
B.P.
6009
HYDROGÉOLOGIE
- 45 Orléans (02)
71 SGN 313 HYD
- Tél.:
(38)
66.06.60
Septembre 1971
RESUME
Lorsque la quantité de données hydrogéochimiques devient trop
importante
(supérieure à 50),
les moyens classiques de traitement,
calculs de rapports caractéristiques,
ou de PIPER. . . ,
nécessitent de longues opérations
calculs automatiques
térêt grandissant.
tels que
diagrammes de SCHOELLER-BERKALOFF
;
aussi
les méthodes de
faisant appel aux ordinateurs présentent-elles
Elles permettent l'exécution plus rapide
et plus
un in¬
complète
d'études hydrogéochimiques.
Ces programmes
de traitement de résultats d'analyses faites
terrain ou au laboratoire ont été
avec
le
concours
chimiques,
de
du
département Informatique
statistique
La présente
le cadre des études
ces programmes au
françaises.
souligne
méthodologiques,
traitement d'une
par ailleurs
l'intérêt de
différentes
:
programmes
d'analyse
réalisée par le
L'utilisation conjointe
comparaison des
de
élémentaire,
étude,
sur le
mis au point au département Hydrogéologie
département Hydrogéologie
est une application de quelques-uns de
cette
l'originalité des eaux minérales.
dans
soixantaine d'analyses d'eaux minérales
du diagramme
familles
de calculs hydro¬
factorielle...
méthode
d'eaux,
de SCHOELLER-BERKALOFF
dans
la classification et la
et permet de
poser le
problème
SOMMAIRE
RESUME
INTRODUCTION
I .
METHODES
D'ETUDES PAR CALCUL AUTOMATIQUE
1.1.
Les données
1.2.
Les programmes
1.2.1.
HYCH
:
Programme de calculs hydrochimiques élémentaires
1.2.2.
GRAD
:
Programme de graphiques
1.2.3.
AFACl :
Analyse
1.2.3.1.
factorielle des
correspondances
Observations à partir d'un traitement ne faisant
intervenir que
1.2.3.2.
bidimensionnés
Observations
des paramètres
chimiques
sur un traitement avec paramètres
chimiques et physiques
2.
1.2.4.
PIPER
1.2.5.
Conclusions
UTILISATION
DU DIAGRAMME DE SCHOELLER-BERKALOFF
2.1.
Le
diagramme
2.2.
Originalité
2.2.1.
SCHOELLER-BERKALOFF comme
des
moyen de
comparaison
eaux minérales
Minéralisation des eaux
2.2.2. Ces eaux ont-elles un faciès particulier ?
2.2.3.
3.
Où faut-il chercher l'originalité des eaux minérales
?
2.3.
Relation entre le chimisme et le rôle thérapeutique des eaux minérales
2.4.
Conclusions
CONCLUSIONS GENERALES
REFERENCES BIBLIOGRAPHIQUES
PLANCHES
LISTE DES FIGURES
1 .
HYCH
: Annexe
1
sort les données telles qu'elles
2.
HYCH
: Annexe
2
imprime les résultats
des calculs
erreur,
pourcentages...
3.
GRAD :
Comparaison de deux
4.
GRAD : Comparaison somme globale
(C+) -
5.
GRAD : Comparaison somme globale
(A-)
6.
AFACl
7.
:
Traitements
avec
sommes
(C+,
A-)
somme partielle
- élément
balance ionique,
(AT = CA + MG)
(CO = HCOo)
6.1.
Paramètres
chimiques
6.2.
Paramètres chimiques et physiques (axes 1.2)
6.3.
Paramètres chimiques et physiques
sulfaté
:
seuls
passage
Diagramme
9.
Comparaison eaux minérales
du faciès
bicarbonaté calcique
de PIPER
-
eaux
souterraines
9.1.
Faciès bicarbonaté calcique
9.2.
Faciès
9.3.
Faciès chloruré
9.4.
Faciès
=
(axes 1.3)
calcique
8.
* meq
globales
de meq,
en machine
:
Diagramme SCHOELLER-BERKALOFF
au faciès
sont entrées
sulfaté
mixte
milliéquivalent
calcique
sodique
banales
3 bis
Quelques
Laux
Eaux Minérales
e.\-\j¿\t.tí
danf
te.
Françaises
rci*^or{-
Hout-Rkin
INTRODUCTION
Beaucoup d'auteurs
minérale"
ne
ont cherché à
sont pas toutes chaudes)
d'entre elles
;
de
gisement ou l'origine
dites
minérales
par exemple Evian) ;
des,
qui
1957,
pris en application de
stipule
(mais certaines
d'autres encore le
définition physico-chimique des eaux
rigoureusement acceptable ;
une définition administrative qui résulte
mai
"l'eau
de l'eau. . .
Il est difficile de trouver une
24
définition de
(mais les eaux minérales
d'autres le taux de minéralisation
sont très peu minéralisées,
mode
le
donner une
: certains faisaient intervenir la température
la
seule admise actuellement est
du décret du 12
la
législation
janvier 1922,
modifié
sur la répression des
frau¬
:
Article 1^"^ ...
"Les
toute
autre
dénominations
contenant ces
thérapeutiques
en vigueur.
dans
La deferrisation
d'eaux minérales
par le
mots
provenant d'une
décision ministérielle,
décret n°
autorisées
57-404
du
"eau
minérale",
"eau
minérale naturelle",
sont réservées aux eaux douées
source
dont l'exploitation a
les conditions prévues
par les
été
lois
peuvent avoir lieu que
28.3.57
sur la
police
et la
dans
les
de propriétés
autorisée
par
et règlements
et le mélange entre eux d'eaux et de
ne
ou
gaz de
sources
conditions
surveillance
fixées
des eaux
minérales" .
Donc,
contrairement à celles
définition met essentiellement l'accent
proposées par les géologues,
cette
sur les propriétés thérapeutiques de ces
eaux.
Ne
faire un choix
:
embouteillées
:
pouvant traiter toutes
89
Vichy
Saint-Yorre
les
eaux minérales
sur les
eaux les
françaises,
plus
connues
millions de cols en 1969
205
Badoit
Vais
les
d'où cette étude basée
55
Bains
26
Vittel
519
Contrexeville
407
Perrier
332
Evian
548
auxquelles ont été
d'Enghien
comparées les eaux minérales
:
(Seine-et-Oise)
des Pyrénées
du Massif Armoricain
du
Haut-Rhin
(Sassay :
16 millions de cols en 1969)
il a
fallu
et les
plus
1 .
METHODES D'ETUDES PAR CALCUL AUTOMATIQUE
1.1. Les
données
Cette étude repose
chimique d'eaux minérales,
prenant le dosage
sur des résultats
analyses
des éléments majeurs
:
Ca2+ ,
- Anions
:
Cl' , SO^~ , HCO ~
-
-
l'eau
ou
de
la composition
Mg2+ , Na"^ , K"*"
des majeurs
quelques renseignements qualitatifs
dans
de
c'est-à-dire com¬
principaux :
- Cations
Aux concentrations
d'analyses
de type classique,
s'ajoutent
:
sur l'existence d'éléments en traces
gaz dissous
des renseignements relatifs au lieu de prélèvement de l'échantillon et
quelques paramètres physiques de
Ces analyses
de
1961.
de
sources,
sont issues des
Parmi celles-ci,
les
l'eau.
données
beaucoup
"statistiques
sont anciennes
de l'industrie
:
minérale"
pour un certain nombre
sont le résultat de longues recherches dans d'an¬
ciens périodiques et de recalculs pour transformer en mg/l d'anions et cations,
des
(Dr.
compositions
B.
chimiques parfois exprimées en composition hypothétique
NINARD).
Du fait de l'origine très variée
de ces analyses,
il faut dès mainte¬
nant faire des réserves quant aux conclusions qu'on pourra tirer des traitements
ultérieurs.
1 .2 .Les programmes de traitement
Des
programmes
lement pour l'hydrochimie
de traitement automatique,
(ex.
HYCH),
adaptables aux problèmes hydrochimiques
mettent la réalisation rapide
saires
1.2.1.
à
une étude
certains
conçus
spécia¬
d'autres d'intérêt plus général mais
(ex.
traitements
statistiques) per¬
des calculs et représentations graphiques néces¬
:
HYC^H transforme en meq/l les résultats des analyses chimiques exprimés
en mg/l et permet ainsi la comparaison des eaux entre elles. Il calcule
également la balance ionique et les pourcentages des différents ions.
peut calculer,
(fig.
1.2.2.
1
GRAD :
à
la demande,
un certain nombre
de rapports
Il
d'éléments
et 2).
programme de
statistique élémentaire permettant de comparer les
éléments deux à deux (en milliéquivalents) ;
représentées
:
les analyses peuvent être
par une croix indiquant leur position par rapport aux éléments représentés
les deux axes orthogonaux (ou par un astérisque
si
sur
plusieurs échantillons
ont même position) ;
par le numéro du
groupe
dans
lequel
on a rangé
l'analyse
a
priori
;
par le numéro repérant l'échantillon au cours de tout le traitement ;
a)
La comparaison des deux sommes globales A"
(somme totale des anions)et C+
(somme totale des cations) permet de repérer les échantillons
figure 3) qui
ceux qui présentent un trop
grand pourcentage
(l'erreur maximum admise étant fixée à
moyen est basé
tion
de
sur la fiabilité des
l'expérimentateur...
liorant de plus en plus,
actuellement,
Mais
étant anciennes,
méthodes
les résultats
sur la
5
%
;
dosage,
de
et les
les erreurs d'estima¬
l'appareillage
diminuer la valeur du pourcentage
il est préférable
étude
des
de conserver la
bonne estimation de la com¬
eaux et élimine tout de même les
analyses à balance
que certaines eaux pour lesquelles
montre
s'amé-
aussi,
dosages ayant été effectués dans
détail,
;
ce pourcentage
des analyses utilisées pour cette
(bicarbonates et gaz carbonique
La figure 3
de
dosage,
celle-ci permet d'avoir une
mal équilibrée telles
sur la balance ionique
sont de plus en plus précis ;
un certain nombre
les prélèvements
position chimique des
sait 20 %
les
d'erreur
% depuis longtemps ;
appareils de
dont on ne connait pas le
marge d'erreur de
ionique
;
5
serait-il peut-être possible
d'erreur admis.
conditions
(encadrés
s'écartent trop de la bissectrice où A~ = C+ et d'éliminer ainsi
l'erreur dépas¬
sans doute dosés ensemble)).
un exemple de graphiques
où les échantillons
sont
repérés par leur numéro.
Au cours des interprétations
ultérieures,
il faudra éviter de tirer des
conclusions trop hâtives quant à la position des échantillons
ionique
b)
est mal équilibrée
dont la balance
;
Sur la figure 4 où les échantillons sont repérés par leur numéro de groupe (et il
en
sera ainsi
sur les figures
MG des alcalinoterreux
AT
suivantes),
somme partielle CA +
à la somme totale des cations C"*" fait déjà appa¬
raître plusieurs groupements ;
les numéros de groupe)
le rapport de la
on distingue
(les chiffres entre parenthèses
sont
:
- les eaux de Contrexeville
(2) + Vittel Hépar (2) + les eaux du Gard (5) ainsi
que Vittel (2) + Perrier (5) + les eaux d'Enghien (6) dont 90 à 100 % des cations
sont des alcalinoterreux.
- Badoit (3) un peu moins riche en alcalinoterreux.
- Les eaux du Haut-Rhin (7) qui ont à peu près autant d'alcalins que d'alcalinoterreux.
- Les deux groupes d'eaux de Vichy
Quelques remarques
(1) et Vais
(4) nettement plus alcalines.
s'imposent :
- Les eaux des Pyrénées prises en exemple
(8) n'ont pas beaucoup d'unité
(elles viennent de bassins hydrologiques différents).
- Certaines eaux du bassin de Vichy
que
assez
semblable à celle
ports ou de valeurs
-
Une analyse
du
(1)
semblent avoir une composition chimi¬
des eaux de Vais
;
de telles
similitudes de rap¬
se retrouveront sur d'autres graphiques
groupe des eaux de Vais
s'individualise
:
(ex.
fig.
c'est une
5).
eau dont
la balance ionique est mal équilibrée : plus de 7 % d'erreur (^i)).
c) Rapport somme globale à élément (fig.
fonction de la
somme des anions
bicarbonatés,
la
majeure partie
représentés par HCO3
bicarbonates
,
des Pyrénées où la
celle
: l'étude des bicarbonates
;
des anions
où les
:
^ (SO|) +
(Cl~)
certaines de Vittel,
;
quelques
eaux du Haut Rhin et
et Cl" est très
supé¬
en HCOÔ.
l'étude a pu être complétée par des comparaisons élément
à élément : par exemple le rapport Ca/Mg distingue,
ques
et 1 00 %
même quelques analyses
somme des concentrations en SO4
d) Dans le cas présent,
terreuses,
(CO) en
une prépondérance des faciès
des eaux ayant entre 75
dégage tout de
(HCOr)
eaux de Contrexeville,
rieure à
se
sont moins importants
- eaux d'Enghien avec
-
Il
5)
(A-) montre
celles qui
sont plus
et la comparaison K -
(ou aussi)
Na
montre
parmi les eaux alcalino-
magnésiennes
que
les
(ex : Vais) que calci¬
eaux d'Enghien ont un rapport
K/Na double ou triple de l'ensemble des autres eaux traitées.
Ainsi,
cette
à
l'aide du programme GRAD peut-on déterminer le
eau,
mais
méthode nécessite
ques
si on veut connaître les faciès avec
être d'un autre intérêt :
ensemble homogène,
la réalisation d'un grand nombre
faciès
de
d'une
graphi¬
suffisamment de précision (GRAD peut
dans le cas du traitement de données relatives à
ce programme permet de rechercher ou de vérifier
un
s'il
existe une corrélation entre divers éléments).
,2.3. AFACl
:
Analyse factorielle des correspondances
âû'point par BENZECRI J.P.
(197 0)) :
Soit une population de
analyse chimique) et
m
simultanément les
par les
variables
m
tillons
nuage
1-3
de
sortie,
n
individus
(les
n
m
individus
et inversement,
défini par les
En
n
variables
représente
dimensions
(dont la méthode a été mise
les
(échantillons représentés par leur
éléments dosés par analyse
dans
m
l'espace
éléments
à
m
AFACl
dans un espace à
défini
n
individus.
on obtient un graphique représentant le nuage
et les différents pôles-éléments.
selon plusieurs
).
dimensions
directions
des échan¬
On peut demander la représentation du
au choix,
les
graphes
selon les
axes
1-2
ou
(axes d'inertie principaux du nuage de points) rendant compte en général
80 à
90 %
de la variance totale
de la population.
L'examen des graphes
1.2.3.1.
-
quelques
observations
Traitement ne cori_sj.dérant que le s paramètre s_ chimique s
les
pôles
(fig .
6.1)
:
a) l'intersection des axes
b)
appelle
les pôles-éléments
1
et 3
correspond au centre de gravité du nuage
;
sont répartis dans tout l'espace ;
c) les pôles "sommes d'éléments" tels que AC (= Na"^ + K"*"), AT (= Ca2+ + Mg^^)
et CS
la
(= Cl
somme
NA ;
les
;
+ SO4
ainsi,
alcalins
)
AC
sont les barycentres des pôles dont ils représentent
est aligné entre NA et K,
sont donc presque
sodium pour l'ensemble
de
et presque
la population considérée
;
AT,
est tel que le rapport MG. AT/AT. CA est environ de 2,5
pour la population entière,
il y a
confondu avec
exclusivement représentés
;
par le
entre CA et MG,
ceci
statistiquement environ 2
signifie que
fois et demi
plus de Ca2+ que de Mg2+ dissous dans les eaux (ceci est guère signifi¬
catif puisque la population n'est pas homogène).
- le
nuage d'échantillons
:
a) il montre un regroupement des eaux
b)
selon les différents faciès chimiques
.
Vichy
bicarbonaté
sodique
.
Vais
bicarbonaté
sodique
.
Badoit
bicarbonaté plus alcalino-terreux
.
Evian
bicarbonaté calcique
.
Perrier
bicarbonaté calcique
(plus riche en sulfates)
.
Vittel
bicarbonaté calcique
(+ SO^) à
.
Contrexeville
sulfaté calcique
ces graphiques permettent également de
chimique net à un autre ;
(plus potassique et magnésien)
sulfaté calcique
suivre l'évolution d'un faciès
(ce genre d'observation peut être particulièrement
intéressant dans l'étude d'un même aquifère
:
évolution du chimisme de
l'eau d'une nappe avec l'éloignement de la zone
d'alimentation par exem¬
ple. . .).
Exemple
:
Pôle
SO4
-
Ca
Pyrénées
(Capvern)
Contrexeville
Vittel Hépar
Vittel Grande
Vittel Alpha
Perrier
Pôle
HCO
-
Ca
:
Evian
Source
dont on peut
suivre le passage SO4
SCHOELLER-BERKALOFF
(fig.
Mêmes observations
Pôle HCO3
>
HCO3
sur les
diagrammes
de
7).
avec la
- Na
suite
.
:
Vichy
Haut Rhin
Badoit
Pôle
c)
HCO3
-
Ca
Evian
de même qu'il fait ressortir les affinités,
échantillons particuliers
Exemple
:
AFACl
permet de distinguer les
:
Source Sassay à Planco'ôt (Côtes du Nord) à faciès mixte bicar¬
bonaté calcique
sulfaté
sodique.
(point S
sur la fig.
d) Si on ne fait intervenir que des éléments ou des
ques,
AFACl
n'apporte pas beaucoup plus
me de PIPER,
dans
le
mais
fait qu'on
6.1)
sommes d'éléments chimi¬
de renseignements
l'intérêt de ce programme d'analyse
peut choisir n'importe
quel pôle
;
ainsi a-t-on la
bilité de faire intervenir d'autres paramètres tels que
concentration,
résistivité.. .
d'interpréter les
pH,
les
pôles
et de tenter d'établir des corrélations et
pôles chimiques
l'espace,
les
même
série
de
données
sont maintenant regroupés
^^
dans
un rapport entre
alors que
l'hémisphère inférieur ;
les différents
est indépendant de tous
échantillons
que précédemment.
dans la partie
déterminant grossièrement un plan,
température
-
la
est nettement isolé
qu'il y a
^
:
On étudie
T"
possi¬
température,
phénomènes.
1.2.3.2. Ipjtrpdiictipn _de par^ipètre^ E^Y.^i'^i^? 1 i^ 1^PP5'^.?14£^ ^^^9
-
qu'un diagram¬
factorielle réside
les
pôles
cette
chimiques
autres
le
Tous
supérieure
pôle
de
"température
disposition
mais
les
que
le
montre
facteur
pour la population considérée,
:
On retrouve à peu près la même répartition des individus que dans
le premier traitement,
pôle T pour les
des points
mais il y a distorsion du nuage et attirance vers
eaux ayant une
est ici
forte température à
fonction de la
l'émergence.
composition chimique et_de
La
le
position
la température.
10
Cette influence
ment bien individualisé,
de
la température
est nette
au niveau d'un groupe¬
par exemple celui des eaux du bassin hydrominéral
de Vichy qui est caractérisé par un faciès homogène bicarbonaté
6.1)
sin
;
sur la figure 6.2,
s'étale vers le pôle T,
plus
élevée.
On trouve
(
1 . (
(
statistique,
dans
l'ordre
:
Eaux de St. Yorre
)
Eaux de St.
)
Priest Bramefant
Priest Pragoulin
T de 12
14°C
)
T = 17,3°C)
3.
Vichy Hôpital
T = 34,4'=C
4.
Source Boussange
5.
Vichy Grande Grille
dans les
(Bellerive)
T = 41,5°C
T = 42,5°C
conditions d'observations,
que la température n'ait pas
il
d'influence
ments des eaux du bassin de Vichy puisqu'on observe
blables pour toutes
ces
eaux,
On n'en concluera
composition chimique
Cependant,
à
Vichy Cèle stins
Ainsi,
vue
des
quelle que
pas que
eaux,
sur les rapports d'élé¬
des rapports
soit leur température à
la température
ce qui
la variation du TDS
semblerait du point de
de
Le
même
n'a aucune influence
serait contraire aux lois de
débit ou
faciès
chimique,
la
fois. . .
montée relativement lente
di -^sèment progressif à
qui
concerne
vidualisés,
cée
les
eaux
de telle
de
:
les
que
:
même
lithologie,
vitesses
mais à
jusqu'à
la
surface,
de température plus
remontée rapide
la température
profondeurs
de remontée variables
géologie et de
mentaires pour la
des eaux
de
eaux du Bassin
surface
ou
leur
pourraient résulter d'une
d'où
faible.
En ce
ces
eaux est moins
influen¬
eaux arrivent encore chaudes à
différentes
?
:
eaux dont les tem¬
de deux aquifères de
ou eaux juvéniles à
? ? . . .
des
la géochimie locales apporterait des éléments
connaissance de la
re¬
un refroi¬
par des chenaux mieux indi¬
la température géothermique
des
la
Une étude très détaillée des conditions d'émergence
de la
source n'est
ces eaux ont un réservoir
D'autres hypothèses pourraient être avancées
pératures correspondent à
des
de remontée vers
"froides"
les terrains
"chaudes"
manière
eaux
façon diffuse
travers
ou PIPER,
supposer que toutes
par celle des terrains traversés et les
l'émergence.
la chimie.
'"Ifempérature-Chimie"
selon AFACl
et que varient leur vitesse
les deux à
sur la
Yorre.
hydrominéral de Vichy peut faire
profond commun,
sem¬
{- Total Dissolved Solids calculé à partir des
significative pour confirmer la dépendance
la région de Vichy-St.
assez
l'émergence.
données des Annales des Mines) en fonction de la température à la
pas
(fig,
faisant apparaître celles dont la température est
ainsi
et St.
(2.
sodique
le nuage de points correspondant aux eaux de ce bas¬
genèse
de
ces
sources,
supplé¬
eaux minérales.
11
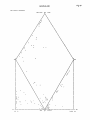
1.2.4.
PIPER
(fig.
8)
Quand on ne veut faire intervenir que les 7 cations et anions majeurs
(Ca2+, Mg2+, Na+, K"^ , Cl", SO^ , HCO3), on peut utiliser un programme
de tracé automatique de diagramme de PIPER.
Le diagramme tracé à l'impri¬
mante est déformé (pour des raisons de commodité de programmation avec
l'ordinateur IBM 113 0-8K) mais l'interprétation reste inchangée.
Diagramme
Diagramme non déformé
déformé
On constate que la répartition des échantillons et les groupements
sur le diagramme de PIPER sont bien les mêmes que sur le premier traite¬
ment AFACl
(fig.
6.1) qui ne considérait que les paramètres chimiques.
(Pour les mêmes résultats avec les éléments majeurs,
PIPER à l'imprimante
met 10 fois moins de temps machine).
1.2.5.
Conclusions:
Cette courte étude
cilitée
sur les eaux minérales françaises a donc été fa¬
par l'utilisation des programmes de calcul automatique disponibles
actuellement au département Hydrogéologie ; ces programmes de calcul et
de statistique ne sont que des "outils rapides" pour l'élaboration des docu¬
ments nécessaires à toute étude ; ils
sont d'un maniement simple et toute
étude hydrochimique portant sur un nombre d'analyses dépassant 50 devrait
maintenant toujours commencer par l'utilisation de HYCH et PIPER,
et AFACl
GRAD
n'étant utilisés qu'ensuite de façon réfléchie pour rechercher ou
montrer l'existence de corrélations et interpréter. . .
Compte tenu de la dispersion des sources,
de l'éloignement et de la
grande variété des gites géologiques et géochimiques des eaux considérées,
on ne peut avec l'aide des documents établis automatiquement,
que faire une
description typologique de ces eaux ; une étude plus approfondie en vue de
déterminer l'origine des eaux et de leur chimisme,
considération de la géologie,
nécessiterait la prise en
de la géochimie et de la climatologie locales...
mais là n'est pas le but de cette étude.
12
2.
UTILISATION
2.1.
Le
DU
DIAGRAMME
diagramme
comme
Il a déjà
moyen de
comparaison
été question de quelques
raison d'analyses
matique
SCHOELLER ET BERKALOFF
procédés automatiques
chimiques.Il est intéressant de
et automatique,
représenter toutes
les
un certain nombre
de
d'une eau en
utilisant le
chaque
concentration de
les
de
façon à
par une
de
bases,
diagramme
unitaires
ou de
de PIPER. . .
:
celui-ci
brisée, profil caractéristique
solution dans
distance les
systé¬
composition chimique
SCHOELLER-BERKALOFF
ligne
ion majeur en
aligner les valeurs
le
de compa¬
façon
l'eau,
unes des autres,
des
les
de
la
six échel¬
étant décalées
milliéquivalents
des
différents
et cations.
Ces profils
entre elles
suite
;
;
permettent de
c'est dans
ils
autre comme
2.2.
chaque
logarithmiques à égale
anions
la
diagramme
analyse
d'une
calculs de
analyses par un point dans
Mais il est possible également de visualiser la
représente
faire,
ce
mettre
but que
les
en évidence la
peuvent aussi montrer le passage
l'illustre
la
figure n°
parenté
diagrammes vont être
d'un faciès
des
eaux
utilisés par
chimique à
un
7 .
Originalité des eaux minérales
2.2.1. La jnmérali station de_s_p_ajj.x
Dans
plus ou moins
ficiel,
toutes
les
(pH,
Eh,
température,
sels des terrains traversés ;
sels en
eaux,
quelles qu'elles
Au cours de leur trajet
soient,
souterrain ou
sont
super¬
les eaux dissolvent en quantités variables, en fonction de certains
paramètres
les
la nature,
minéralisées.
solution confèrent à
Le
fait d'être
pression,
produits de solubilité...)
les quantités relatives des
l'eau
différents
son faciès prédominant.
minéralisées,n'est donc pas caractéristique
des
eaux minérales.
2.2.2, Ces eaux ont-elles un faciès P5£ti5_}^ii.^r ?
On peut trouver,
du Nord),
des eaux ayant une composition chimique
de certaines
semblable à celle
eaux dites minérales.
Prenons
a)
en France comme à l'étranger (ex : Afrique
quelques exemples
faciès bicarbonaté calcique
(fig.
:
9.1)
On peut rapprocher la composition de
l'eau
"minérale"
source Montfras à Chambón la Forêt dans le Loiret,
caires de Beauce aquitaniens
(RS = 345,5
mg/l),
prélevée au Cap d'Ambès dans la nappe des
la
issue des cal¬
de celle d'eau
sables lutétiens
23 0 mg/l) ou de celle d'une eau du N du Bassin Parisien
mg/l) .
de
(RS =
(RS =35 0
13
b)
faciès
sulfaté calcique
(fig.
9.2)
Les eaux de la nappe phréatique dans l'infracénomanien
argiles,
gypse,
concentrée
anhydrite)
du plateau des phosphates au Maroc
par dissolution des
sels
des terrains encaissants
:
(grès,
(eau
RS
= 267 0
mg/l) et celle s de la nappe phréatique profonde du bassin de la Moulouya
dans le Néogène continental
beaucoup de
Vittel
c)
(RS =255 0 mg/l) au Maroc également,
similitude avec les eaux minérales
ont
sulfatées calciques
de
(RS = 2715 mg/l) et Contrexeville (RS =1935 mg/l).
faciès chloruré
sodique
On peut de
(fig.
9.3)
la même
façon trouver des ressemblances entre
eaux de la nappe captive du Plioquaternaire
croûtes
(alluvions
des
fluviolacustres et
salines) de la plaine du Rharb au Maroc et les eaux minérales de
Balaruc-les-Bains
d) faciès mixte
dans
l'Hérault.
: bicarbonaté calcique - chloruré
sodique
(fig.
9.4)
Un parallèle existe aussi entre une eau émergeant d'un cal¬
caire gréseux marocain ou de l'Albien en Normandie,
et la
source minéra¬
le de Sassay à Plancoët dans les Côtes du Nord (granulite,
émergence' au
contact d'une couche de kaolin).
On pourrait citer encore de nombreux cas
des eaux de nappes quelconques
quelques exemples
nières n'est pas
2.2.3,.
suffisent à
et des eaux dites
de ressemblance
"minérales"
n'est pas
une
ces
der¬
"extraordinaire".
leur température :
température à la
mais
prouver que le faciès chimique de ces
Où faut-il alors chercher l'originalité des eaux minérales
a)
entre
?
certaines eaux ont attiré l'attention par leur haute
source
(ex : Vichy Grande Grille 42,5°C. .).
généralité,
Mais ce
et la plupart des eaux minérales ont une
pérature voisine de celle des eaux de nappes banales
(ex :
tem¬
Sassay à
Plancoët (Côtes du Nord) 11,9°C; Vittel 11°C).
b) la radioactivité et les éléments traces : il est très difficile d'affirmer quoi
que ce
soit quant à
ces paramètres car la
très grande
seignements chimiques relatifs aux nappes ne
analyses chimiques classiques,
c'est-à-dire comportant seulement le
dosage des anions et cations majeurs : Cl,
Na,
pas.
K.
Certaines eaux minérales
Il est probable
que des
traces,
granites
toutes
contenir,
ceux-ci
que
des
eaux,
SO^,
HCO3,
sont radioactives,
aussi radioactives.
quelle que
mais il est difficile
(NO3),
Ca,
d'autres ne le
eaux qui ont circulé dans
peuvent être
les
majorité des ren¬
sont en général que les
des roches
Mg,
sont
telles
Quant aux éléments
soit leur provenance,
doivent en
d'en donner des preuves irréfutables car
sont très rarement dosés.
14
2.3.
Relation entre le chimisme et le rôle thérapeutique des eaux minérales
Les eaux minérales
banales,
et
si
s'apparentent
on ne considère que les
pas avoir d'influence particulière
2.3.1.
souvent à des eaux de nappes
éléments
sur la
elles ne
devraient
La radioactivité
La valeur thérapeutique
à
de nombreuses
de la radioactivité
discussions
entre
médecins
petit nombre de données dont ils disposent,
de
2.3.2.
majeurs,
santé de l'homme.
dans
les eaux donne lieu
hydrothérapeutes
et le trop
ne leur permet pas
de tirer
conclusions .
La_température fip_]^'_pau
Elle n'a
pas
un rôle thérapeutique
qu'une température élevée
posés
de
l'eau
accélère
en elle-même,
mais
l'action bienfaisante
sur les fonctions biologiques
il
de
déficientes du
est possible
certains
malade.
les eaux de Vichy et de Vais peuvent traiter les mêmes maladies
de la nutrition et de
ses organes principaux : foie,
mais
de Vais
(A.
les indications
ROBIN,
1923)
si celle-ci esta
2.3.3.
;
sont moins nettes
estomac,
car ces
eaux
com¬
Ainsi,
(maladies
diabète. . .)
sont froides
de même l'action diurétique d'une eau est accélérée
20 ou 3G°C
au lieu d'être froide
(P.L.
VIOLLE,
1923).
Les _é_lé_me^rit_s_ tra£e_s
Exemple
:
soient deux
- Grande Grille parmi
bouteillée,
-
des
très
les
plus
utilisée presque
Source Chomel,
lée,
sources
distante
de
utilisée pour les
de Vichy
connues
:
des
sources
de Vichy,
très em¬
exclusivement en boisson
50 m
soins
de
Grande Grille,
très peu
embouteil¬
externes.
Ces eaux ont la même composition chimique au niveau des
majeurs
gaz ;
ces eaux
cependant,
elles
ont un rôle thérapeutique
contiennent les éléments traces
Chomel
Al
-
Al
Ll
-
-
Fe
-
Mn
différent ;
:
Grande Grille
Ba
Peut-être
suivants
-
Fe
-
Mn
Li -
Sr
les traces
Ba
-
Sr
As
-
Br -
supplémentaires As - Br -
F
- I
- P
F - I et P confèrent-
elles à Chomel les qualités que ne possède pas Grande Grille
Donc un même faciès hydrochimique majeur peut
différentes.
et
?
soigner des maladies
15
Inversement,
des
rents peuvent traiter à
Exemple
eaux de faciès hydrochimiques majeurs diffé¬
peu près
mêmes maladies.
:
- Vittel Grande
faciès
les
:
sulfaté
Source
- Contrexeville
et bicarbonaté
nettement
sulfaté calcique
calcique
traces
:
Cu
Ba
-
Fe
-
Mn - Pb -
Al
-H
traitement
:
goutte,
-
B -
Sr - B
lithiase rénale
Fe
-
Mn
Sr
0,61
m^dCi de radioactivité
goutte,
infections
rénales
et hépatobiliaires
et anomalies
2 . 4. Conclusions
Les
très
eaux dites minérales ne
particulier.
Néanmoins,
cependant difficile
de
dire
elles
semblent donc pas avoir un chimisme
sont utilisées
sur quels
en thérapeutique.
critères il faut
se
Il
semble
baser pour définir la
spécialisation d'une eau.
Cela
jeure,
ne
peut
car température,
se
faire uniquement
radioéléments,
les indications et contre-indications
des
eaux de
faciès hydrochimiques
sur la
et traces
composition chimique
ma¬
semblent jouer un rôle dans
de traitement de
la maladie.
majeurs identiques
En effet,
semblent pouvoir
traiter des maux différents et inversement.
D'autre part,
selon
de
son mode
l'eau
malade,
d'emploi
une
;
même
eau
effets antagonistes
aussi le médecin doit-il très
sur l'organisme en fonction de
et de
peut avoir des
bien connaître l'action
son mode d'emploi,
l'évolution de la maladie.
de
la réaction du
16
3.
CONCLUSIONS GENERALES
3.1.
Les méthodes de travail
Les programmes de calcul ou de représentation automatiques per¬
mettent maintenant à
tion
:
une
utilisée
partie
l'hydrogéologue
d'approfondir davantage
seulement du temps passé
aujourd'hui par la calculatrice à
long et fastidieux
:
calculs,
autrefois
en
seuls
l'interpréta¬
calculs,
est
faire tout le travail préparatoire
graphiques,
diagrammes,
histogrammes...
et
sans risque d'erreur.
Mais il ne
faut pas abandonner pour autant certaines méthodes non
encore automatisées
BERKALOFF pour les
montrer la parenté
3.2.
:
ainsi a-t-on vu l'intérêt des diagrammes de SCHOELLER
comparaisons
de
certaines
et visualisations
eaux entre
de
faciès
chimiques,
et
elles.
Les eaux minérales
Un nombre
assez important d'analyses chimiques
a permis de montrer l'intérêt des
d'eaux minérales
programmes de traitement automatique
déjà
disponibles au département Hydrogéologie.
Du fait de
l'hétérogénéité des données,
sources et de leurs
données,
en plus
de la grande diversité des
gites géologiques et géographiques,
cette
série
de
de l'expérimentation des programmes informatiques,
pu donner lieu qu'à
un traitement descriptif des eaux.
n'a
Ainsi est-on parvenu
à établir une typologie de certaines eaux minérales françaises.
De
la considération de la température à l'émergence avec la compo¬
sition chimique des eaux,
tillon considéré,
il
dans les conditions d'observation et pour l'échan¬
semble ressortir que les quantités relatives d'ions dissous
dans les eaux restent à peu près inchangées avec les
température à
Mais
la
source.
les
eaux,
ont en profondeur,
(fonction de la température,
ont en
surface.
grandes variations de
pression,
un équilibre
pH,
physico-chimique
Eh...) différent de celui qu'elles
Vu les origines variées et parfois anciennes des analyses,
et ne connaissant pas les conditions dans lesquelles elles ont été effectuées
(l'analyse
des eaux minérales thermales en
temps après leur prélèvement,
que de l'eau à
sa
laboratoire,
ne reflétant pas l'exacte
peut-être
un certain
composition chimi¬
source et encore moins en profondeur) on ne peut que cons¬
tater les rapprochements et regroupements que nous montrent les méthodes
statistiques.
On a vu qu'il est difficile
"minérales"
(eaux qui ne
de définir ce qui fait l'originalité
des eaux
semblent pas différer des eaux souterraines bana¬
les en ce qui concerne la composition chimique),
et ce qui leur confère un
17
rôle thérapeutique
si important.
(Ici également,
à la véritable composition chimique
Seuls
pérature,
ont été
considérés,
les éléments traces
faut-il chercher ailleurs
par les
la
eaux minérales
station par exemple
miques,
climatiques et
dans
et la
En fait,
sédatifs
médicales,
curatif des eaux minérales.
des
le
chimisme,
eaux,
l'action bienfaisante
ou thermominérales
:
dans
le
calme
mais
la tem¬
peut-être
des traitements
et le
il est probable que tous ces
soient liés.
peute qu'il appartient en définitive,
et connaissances
cette étude,
radioactivité
la raison de
?
la même restriction quant
des eaux minérales est à retenir).
climat de
facteurs
chi¬
C'est au médecin hydrothéra¬
en conjuguant données hydrochimiques
d'expliquer et de fournir un avis
sur le côté
18
REFERENCES BIBLIOGRAPHIQUES
BENZECRI
J.P.
(1970)
Distances
distributionnelle
factorielle
des
(3è édition.
et métrique du Chi deux en analyse
correspondances.
Avril 197 0,
Laboratoire
de Statistiques et mathématiques.
Faculté des Sciences de Paris)
CASTANY
G.
(1963)
Traité
pratique des eaux
(Dunod,
CAZES
P.,
SOLETY
Paris 1963)
P.,
Exemple
de
VUILLAUME
traitement
(Rapport n°
F.
71
SGN
Y.
(1971)
statistique
Application aux nappes
DEREC
souterraines.
de
du Nord de
la
données
hydrochimiques.
France.
098 HYD)
(197 0)
Catalogue des programmes disponibles au département Hydrogéolo¬
gie au 3 0.12.1970.
(Rapport n°
GLANGEAUD
L.
7 0 SGN 354 HYD)
(1953)
Origine des eaux minérales.
(Le monde
souterrain,
1 8è
année,
n°
7 6-77,
Richesses hydrominérales de la France,
MARGAT
J.
eaux
salées du
(Notes et M.
J.
1,
p.
925-927)
(1961)
Les
MARGAT
Vol.
Avril-Juin 1953,
Serv.
Maroc.
géol.
Hydrogéologie et Hydrochimie.
Maroc,
n°
151,
Rabat 1961)
(1962)
Mémoire explicatif de la carte géologique au 1/50 000 de la
plaine du Tafilalt.
(Notes et M.
Serv.
géol.
Maroc,
n°
150 bis,
Rabat 1962)
19
MONITION L.
et NERAT DE LESGUISE M.
Note explicative
de
la carte
(196 0)
hydrogéologique
de la région de
Casablanca.
(Notes et M.
ROBIN A.
Serv.
géol.
Maroc,
n°
131,
Rabat 1960)
(1923)
La
spécialisation
de
la
(Ann,
SCHOELLER H.
Les
maladie.
Inst.
eaux minérales
Spécialisation
Hyd.
etClim.,
t.
fondée
sur les indications
fonctionnelle.
1,
n°
1,
Janvier-Avril 1923, p. 45-54)
(1962)
eaux
souterraines.
(Masson et Cie,
SOLETY P.
des
et VUILLAUME Y.
1962)
(1970)
Possibilités actuelles de traitement automatique par ordinateur
des
données hydrochimiques.
(Rapport n°
VIOLLE
P.L.
7 0 SGN 233
HYD)
(1923)
La diurèse envisagée au point de vue hydrominéral.
(Ann.
Anonyme
Inst.
Hyd.
etClim.,
1,
n°
1,
Janvier-Avril 1923 , p. 55-71 )
(1961)
Mémento médical des
Anonyme
t.
stations thermales françaises.
(1961)
Statistiques de l'industrie minérale.
(Annales des Mines 1961)
20
Symboles utilisés pour les diagrammes AFACl
Symboles
Eaux
Groupe
Bassin hydrominéral de VichySt.
o
Bassin de Contrexéville-Vittel
2
A
Badoit et sa réserve
3
©
Eaux de Vais
4
9
Eaux de Perrier (Vergèze),
(Ardèche)
Chambón la Forêt,
Remarques
:
1
Yorre
Evian,
5
Sassay
Eaux d'Enghien
6
O
Eaux du Haut Rhin
7
+
Eaux des Pyrénées
8
©
Pôles
Pour lire les graphiques,
direction
mettre tous les axes
(tous horizontaux de préférence).
1
dans la même
u
.1
MÓ/L
NO.
CODE
SITUAT10:4
«AL»
T
kO
PH
CA
vjSgls
CCNr:^f:XEVILL»0-<EAT
SCU'^CC*
MG
MA
K
CL
Sü't
ANIC4S
CCi
HCUJ
N03
(a)
?i'n.*
6c<».i>
7i.:
í:o.7
4.4»
11.2
14 7 3.V
'3'J-.»
2...: 7.»
S'.S.J
UP.O
12. 7
3.1*
I,-.5
121;
.u
'3 7.'.
ri3:).»
"ij'i.s
<»P.6
i2.6
3.P»
11.1
1 I 3
. '
ll.i»
-itC.»
2ül«.»
170.5
I3¿.b
LO.l
U.8»
y. 4
1626.7
»l 1 . ,«
CrNiTRCX:vlLL»PRlMA
M¿/L
't/S.»
11 .»'
CCNT«EXF^UL»LEGCKE
Cr'JIr^CXEVILL'PAVILLLN
CAriO.NS
KS
335.5
O.C«
5
. 0
J45.Í
u.O»
3 j
^
. ' i
J47.7
ü.O»
5
í
.
341.6
0.
.
5--
VirrEL
«ALPHl
«
Ii.'i»
UbO.»
'.00.*
113. i'
i'ttó
3. 1
0.0*
3.0
i C '( . >,
w . 'w
396.6
0.0»
3^
VITTEL
«CELLE
SOUriCE»
11.''»
l'«..0.«
':íO.«
1J3.0
3fi.ù
3.f=.
0.0«
4. H
1 3 i.l
J.O
433.0
V .u»
5Í
VITTEL
«LIE NtMSAWt;»
l«.i^..^
612.
l:3<».5
Jb.f
6. 7
Ü.C»
à.fl
1.1 t..b
c.>:
40^.5
C.ü«
5
VITTEL
«LSSAR
't.jO.«
¿s-;^.»
53<».i
ioe.3
lí>.2
4.5«
11.3
l4lL,.l
j.
397.7
0.0«
5 y
VITTEL
«óOt
l'JGO.»
«j¿.»
215. ¿
<»l.f>
4.6
2.2»
ó.?
351. H
VITIEL
»lic:PAK
on. I
13'*.'*
<l1.7
't.2«
i 1.6
lo 7.. 4
SüUKCE
*
1 1.<
'tlj.»
2716.
;
0.:
¿83. Ü
C.o
36 V. 4
//a /
6
0.0*
61
14
.2
*'Ew
CA
M£ii
CATICNS
MC
NA
DALA.NCb
ANIONS
Ï04
CL
cn3
NU3
ICA
TAN
ri,
EKX
.A
30. 2
6. 1
0.9
û . 1
U.3
30 . 7
5.0
C.C*
37.3
^6.o
l.l'»
2023.»
27.3
4.
0.6
0. 1
Ü.3
2j.4
5.8
i.U»
Jl.'9
jl.4
..7»
2182.»
25.5
4.'
ù.b
0.1*
0.3
23.6
5. H
.1.0»
3?. 2
29.7
D.P»
2:'64.«
11. i
0.4
? . V «
C-.3
33. /
5.7
40.1
39.
C.3»
5.6
2.
0./
0.0»
J.I
6.6
3..
0.2
O.u»
0.1
2.7
7.2
7.7
3.
0.3
0 . ' i
U.2
4.3
6.7
26.7
9. .
0. 7
Cl»
C..3
29.4
10. K
3.--.
0.2
0.1»
j.2
O.î
:. i»
(.
2-^.5
2V.6
II..
'
'.'.^
mA
AMLNS
k
CL
.3»
.u4
lo..>
2 .
ii.b
1.7
...,;
. /
;4.4
l J .
l."
0.3*
i.l
269i.»
71.2
27. o
l.l
.. . l «
.
/
nU
^.'.3
.03»
' i.'l
Tj . 3
.
, <
;j
v>.
1R.3
. ' < »
5
'W*
i 'i . '
.
»
5
.7
'>.:-
l'. .3
. l'»
5
.
^' «
5
;
,
H. 7
8.9
-1.2»
656.»
c^.8
3j.^
i.J
J.o»
1.0
î;<».4
7't . .
1Ü.0
li^.l
-0.3*
743.*
oo.o
31."'
1.7
j . .. *
i.j
.7.1
71. w
,
.'J«
5
O.j»
11.0
ll.¿
-C.-"»
>ll.»
lo.Z
27.1
2.Q
j.O»
1.5
3H.5
ol...
0
. <' »
5
6.6
J.O»
36.5
30. i
0.3»
2t8^.«
73.1
¿4.7
l.)
j.i»
^.?
'-ij.T
li=.Z
' .0*
5
7.3
6.4
0.0»
14.5
13.9
2.1»
IC/Ot.-
74.3
¿J.)
1.4
0 . '.
l.J
'}2.h
'< t. .
.c»
6
34. -f
6.2
41.8
^1.3
C.6»
2,^04.»
70.7
¿-.^.-^
2.3
".3»
.J.c
H4.3
1
u»
ú
6.6
;.">
Hl.o
"-U.
. 9
/^^ ^
-1
IOOO
X
10
GROUPEMENT
A-
0
l
GRADUATION
EN
X«
33
UNITES
1
GRADUATION
EN
Y
«
33
UNITES
28
il.
/
/
/
'V
/"
/
/
/
/
/
15 /
/
36/
/
/
H»
i»
o\/
//y. 3
///
^y/
(0
^ti
A-
utntu*
.
7.
-2
7000
X
10
GROUPEMENT
AT
I
O
GRADUATION
EN
X«
20
UNITES
1
GRADUATION
EN
Y
"140
UNITES
^AT/C*. e.S
io
2«
3o
HO
(e
&)
)«
to
5.
_i
1000
60
POINTS
RETENUS
VALCURS
A
L
ÛRIGINt
C*'
0.000
AT
*
X
10
C^
0.000
/y>.^
-1
1000
X
10
GROUPEMENT
A-
1
0
GRADUATION
EN
X«160
UNITES
I
GRADUATION
EN
Y
«
20
UNITES
Co/A- . i.
8000
58
POINTS
RETENUS
VALEURS
A
L
ORIGINE
C0>
0.000
A-
«
X
0.000
/
OCL
CS
i^icJí/-S^yorrm
NA
+
AC
i O MG
»5
I
í"y
7
.
1
Boc/oié
Vo/s
*
'f:^-
o SO
V //7/e/
AT
OCO
'K
LES EAUX
CAO
MINERALES FRANÇAISES
Direction J
= 0,378 _ Direction 3
= 0^030
Pourcent. î
-8;,J5
=6,6}
Echelle let
z.^,9
3
.Pourcent. 3
F'ig ure
_
6^1
50
LES
EAUX
MINERALES
FRANÇAISES
CS
Direction
1
=
0.271 _
Direction 2
Pourcent. 2 =
Pourcent
1
=
63.75 .
Echelle
2
=
9,3
1 et
= 0,108
25,49
QAT
OMG
QCL
NA
AC
co
K
%
®
-*
1-
-*
1
I
1
-t
1-
1
4-
o
®
(S
®
#
o
®
9
+
Figure
-6-2
T 3
CL
'M 6
AT
CO
-t
1
1-^
»-
CA
atî
-J
S??-7^;
o
ft
1
(
1
-1
H
es
°0O
K
NA^ AC
LES EAUX
MINERALES FRANÇAISES
Direction 1
=0,271
^Dlrection3
Pourcent.
= 63,75
_ Pourcent. 3
Echelle
î et
1
3
so
=0,027
= 6/2
=46
Figure
-
6-3
f/3.7
L
B.R.G.M.
DIAGRAMME
DANALYSE
HYDROGEOLOGIE
!..«
.1 tvtx H
E
ff \
E
UHOmUt
flfluré
D'EAU
G
N
0
E
Réi. IM
P
mg/l
oKtm/cm
no
OlRKAlOff
dp
pH
n
Mg++
r
+
Co
NoVk"^
^-
-
ftonc
'
- í?
10O00 -_
-
6
'f' =
3
' :
« *
-_
'- i
!i
-
4 ~
-
1
*
í
r
/
i
8
=
i
I
r '
4
-
î
\
a
J
jl
:
-i
a
tooo
:
í
-
-
4
r
j
2
S
1
» -r
1
;
5
7
-
»
1
7
3
- -
-
r
5
~
-
-
-
Z
^
:
:
7
T10000
2
~
-^
S-:
7
3
IOO
r "*"
a
8
;'
¿
E
- -
r * *3
:
so*'^
":
-
Ê
"
4 0ÜO-
- 300 * OOO ~4'
i
Cl
8000 --
4
-
4
-
3
_1
f
-r
=
-
E *
5
~
7 -j
'
A
1000
9
~
-J
z
1
'
a
z
: :
~
)IM
z" '
S
-
M
I
-
1000
C03
+
_
3
-
^
-
r
' ~i
3
t -=
:
leao
1
4
-
'
-
1
'
-
1
-
J
--
im
z
6
~
7
E-
4
«
-z
3
- 1
~-
E=-
;
e
Ü
\\ioo
\
1
r
I
r
/
~
S
-
i
NO,'
~
4
f' \\-
1
-
ooo-^
\
-
3
Í
a
r
9
5
-
~
/
6
~
10
T
-E
a
3
-
-
~
4
j
:^;
1-7
i" *
A tu
IOO
-
1
~
T'Y
Iñ 7'
^
ï
\
\
100
V
/
-=
7
-^
/
- III''*-.
/
-
T
urce
E«i« 1
inir«4it«ill»
3
S
9 ^
3
' \ / '
\
-
V
-
4
ï
.
;\oo a
1
/
~
/
100 -
_
5
-
IH
~-
1
»
E
6
-^
-
4
-
7
-
s
-
4
r
7
"-
1
-^
r m
'
1
/
-Am
1 I
m
ir
a
A-i
-j
b-
I
y
r
1
-
=-
[.m :
7
10
-;
9
-n
-
0.7
~
O.S
7 -^
a
7
*
-
-
1
*
1
~
1
-
4
-
\
:' * /
i
'-
t'
'-
%
100-
-£
~r Í
V) ^
-
* ~Í
0.»
-
7
4
S
-E
0.T
-^
0.»
"5
a
4
-
-
t
0.9
î
3
-
0.4
I
10
a
^^^
3
- w
'
<
-
i
« ^
- J
^"'>,
\-
4
:
./
1
t 9
6
'
-
'
3
\
tl
T
-^
r
1
:
s
é
r
»
L
1
O.a
^
:
I
9
'i
;
t».
-5
-
10
*
4
r
* ^.^
*,
-
;
-
10
-=
:
^.
-
V
:
:
'//
' 1
^^
-
-
^^^
1
i -
:
3
10
^**«s..
*.' «
<
3
*
:
.*
-
ï
-
«
^
'-.
\
%
*
7
4
:
__
-
0,1
a
--
-=
OJ
J
r
-
~
..
c«tfvtcii (HH
T -Ï
:
: i¡-\
il! >^
'-
0,3
-
:
9
,
Il
~
z r
o.a
~-
a
"
s
-'
--
¡il î
-;
." "
4
O.S
j
3
6
10
5
0.4
-
î
0.»
4
^ \V\\V:
: WA"^ ;^
0.»
' o.a
V A
4
-
IM
)r 1
,'
*
1
-
^
a
-
-
1
loo-j
3
:
:
\
a
» -E
1
4
a
\
9
.
^
4
I
-
\
5
a
\
-
000
f ^
-
c^ 10
1
~
E^
4
3
6
S
* 1
(COs + HCOV)
1000--
3
^
If
-=
-
2
r '
-
é
k
C>iHM
a
E-I
-
í
»
'*-.
.*
:- í í
5
-
...
- ,,-
4
9
0.1
OIAGitAMHE
EAUX
KINERALES
OE
PIPER
FRANÇAISES
S04.CL.S03
100
CA.HG
Fis-e
Fin.S.t
L
B.R.G.M.
DIAGRAMME
D'ANALYSE
HYDROGEOLOGIE
,',.-.,
(/
E
.1 V
G
\cnanim
Figuré
DEAU
E
N
D
BtRKAiOff
E
RéB. »M
p
mo'l
ohnn/ci*i
no
dp
pH
TMMri ^ mg/|
Mg + +
Co
Na\ K
4000-1;
-
"
CkOimkon
asr.M
flmbti
Uo.
ftriacktr
3ro.
'
'lUKi
300 6 OOO
1
SO4'"
Cl
i
Ú
tiUOO
lOOOO-_
»
5
-
1
-
a
4
3
~ ' ^
.:
9
8
:
- * *3
--
- -
:
ae
3
- IIW
I
-J
_
10000
-
-
"
3
, .1
3
-
i
3
3
-
_
IOO
i I
^
-
4
-
1
»
-
-
Í
-
1
--
/
-
t
-
Í
1
::
I
1
"
-
-
IIW
s
4
'-.
J
4
~
T
~L
a
-
:' *
3
1
:
-
t
:
-
4
-
3
-
ï
:
_
a
lOOO
3
-
1
I» -E
~
7
E
»
z
-
* ï
~
3
6
lOOO
1
IM
^
7 '
-
5
--4
^
:
-
I
J^
t
1 0OO -,
Z
Z
j;
s^
_
-~
3
r *
a
-
-
I
1
'
7
4
4
-
"I
90
i
+
COl
a
i
Cw*bM
:
f
4
^
-
-
î
-
(C03~+ HCO3")
- IW
4
-
^
=-
S
z-
1
5"
7
=;
--
J^
9
-
-
I
3
1000
-
~"
'
1-1
-E
1000
3
- -
ê
S
IW
-E
I
Ë- i
-
^
1
r <s
IW
V I
^ i
-
a
-
ë
~
im
~
»
z
5
1000
J
-
4
~
7
4
:
-
-
s
-
*
a
«
-E
a
-E
Í
~
E-
«
:
r '
J
3
r-lW
3"
1
1
-
t
4
-
3
-
E
s
z
I
-
é
_7
~
;
r
'
I.
1
-^
-
-
7
E"
Z
~
-=
-
4
-
-
3
¡
:
3
4
a ^;
^
:
S
9
- 4
a ^
*
"Z ~
-
IM
^ ~
7
4
î
7'
j
-^
-
a -^
~
3
ï
~=
E
-
L
3
a
IOO
'
9
4
:
-
7 ^
_
9
r
-
-E
Z
j:
4
-
;z
-
"
10
t
a
z
^
E" *
I
S
*
3
^
E" '
~
~
1
1
i
»
_
1
^
_
2
100
_
4
-
1
-
3
~
-E
3
-
""
10
-
000-^
1
7
z
~
NO,
9
'r
'-
a
,^.^
;
'
tFafti-l
2
_
-E
.\
9 -£
r '
100
a
^
j
r 7
4
4
ï
-
J
^
7
3
6
-J
h;Â
4
^
'
-
j^
-
S
L-
"
~
IOO
6
3
^*
IH
:
I
I E
I
r
1
a -^
-
:
i:
:
a
It
-
Í
. ftmbfti
9
h^
_
I
3
a
4
-
-
4
^
E
3
1
~
~
r
-
0.»
1
-5
a
^
"
-
t
ï
4
o.a
9
^
^
^
-
4
9
1
~=
o.a
-=
OJ
-Í
0.7
-Z
o,a
-^
4
:
4
,:
~- 0,6
-
a
-
!
I
I'll
9
4
J
0
-
-^
a
'r *
-
100
f -Ë
7
2
^ 0.7
1
i- 1
E- 1
10
~
.7/'-
a
3
J
'
\^
N
"":
=-
~
!-
4
\
4
100
7
. -
_'
s
-
1
7
a
0,3
-
'<
10
0.9 ^
/
3
"
E
-
-
0.4
a
--
7
-"
i
9 ^
\
«
1
^\^. if
4
" 0.3
//
3
:
-
6 -^
-
:a
0.4
I
a
0.9
10
/
I
-
-
5
:
r
;
~-
1
3
-
1
i5
-I
-
:
1
-*
-
4
-2
a
"
\
7
r
1
:^ '
9
-1
2
7
'
-
1
6 -^
_
-
-
/
-
1
~
-
r-
«
'-
í
-
J
o.a
9
-1
-
J
f
'
_
~
rt II
J
'** V
-^
A
z
-
-
9
Ï;
I
^
3
ï
J
4
:
-
11
-_
Z
-.
o.a
A
10
-^
I
-1
4
3
-
:
- _
-
~
1
£
4
-
:
-
-
-
0.1
3
:
:
-
1
-
7
-
4
L
1
-4
9
0.1
i
jF/ y.S.e
L
B.R.G.M.
E
G
E
N
D
E
DIAGRAMME
D'ANALYSE
HYDROGEOLOGIE
Figura
D'EAU
K
Ai
K*t. MC
P
mg/l
»hmi/cm
oo
BtRKAlOff
pH
4p
i-,-,.
+
Mg + ^
Co
Cl
~
SO4
4 OOO
-
-
^
'two
300 aooo
\
-
\
''
'
d
10000
3
s
--
'
o
i^iV
Piftt-. P0>(
iC^o
H- K9'>;(«.
Zito
'
J
- iw
r
y/;(tu
+
Na -f- K
aoùo
9
z
-S
2
E
IIM
a
e
1
- 1 a
10000
3
-_:
r
1
^~
'
T
4
-
UM
9
--.
4
3
3
-
-
]
7
5 -~
4
3
Í
-
^ IOO
3
-
4
f
-
3
5
-
I
-
Jt
f- »
~9
-E
0
^
s
-
i
""
1
4
-_
3
IOOO
^
-
3
rr.
^ %
a
ft
~
4
4
E
r '
7
1
6
T
"~
E
_'
9
-
a
J
=
z
^^
5
Z
é
1000
'
^
a
~
-
T '
IOOO
-
-
-
7
-J
IW
E"
'
a
.=
r
k.
5
_
4
3
_
-
9
-
3
-
'1
3
* V
s
f\
h \
^
--.
K\\
:i
:V^
r <
3
3
10
ta
E
1
E^
Í
a
-
^ \
i
w/ "
r/ :i
5
r
1
-
Í
-
1
:
-
M
'û-E
> >
9 ^
4
I
1
/
^^^
a
)«
1- J
9
-
r
1
'-
1
'-
1
100
^
4
4
-E
-
i
7 -^
-4
1
3
a
0.»
-=
4
3
1
9
-
*
-^
0.T
-^
o,a
"5
=
i
in '
o,«
:
. 1
-N^
Il
4 4 -
-
1
E -
w
-
-
'
*
"
-
~
1
-
^
-
0.9 ^
ï
E-
^
:
a
--
^
-
:
--
TtTotf ^atci" E
~
'
-
6
~
_
~
T -^
du
I
l
1
V
9 -E
0.4
7
.ViltU Ht|« 9vtftï
-
1
-
E- o.a
»
^
S
4
-Ë
r-
^>^^. r 7
E- 0.»
a
* ~
100
4Í
0.4
10
i
9
-
I
-
]
4
10
-E
7
a
3
0.3
1
1
100
4
r 0.7
000-^
4
3
1
1
-
'-
m
4
-
7
^
Z
a
NC>]
» ~
r
-
-
»
3
1
Ê- 1
m
4
ï
IM
r
\
6 -^
~_
1
S
-
-_
_
~
-
7
0.4
ï
-
_
-
7
Il
ï
4
0,3
-
*
3
O.a
'-
i
r
1
r
'
4
-'
-'
-
;
10a
s
' "Z
f
0,3
-:
_
10
3
--
:
a
--
7
~
^
~
s
-
«
-
i
-
Il
:-
s
~T-
I
- Il
-E
z
:
8 -E
10
7
--
* ~
:
A
-~
^
i
S
T
-
»
Z
r
1
-5
-
Í
= -
(
E
-
s
3
,i
Z
o.a
:
9
10
3
^
I E '
4
-
3
-
:
b
-
0,1
a
I
_.
1
J
1
-
"-
E
~ *
-4
,
'
I i. ,
E *
E
:
I
^
-=
:
4 -I r
-
4
-
3
9
:
-
1
d
\ *
î
100
5
'^
^
4
\
h-
_
~
1
.
Í
\
1
7 ^
3
»
1
I
1000
a -E
9
r
-
\-
-E
1
1
?\
a
^
4
;^
3
4
- IW
a
» ^
^
z
7
~
3
E" 7
:
3
a
I
s
-4
ru
10
-
r
1
1
' ^
tooo
3
a
CMibM
(C03~+ HCO",")
/\
~
»
*
~
-
i
^3
co,
a
^
Z
»0
Í
+
3
4
-
:
r- IM
3
r
*
0.1
rC)l.
^5 .
L
B.R.G.M.
E
G
E
N
D
s.3
E
niûr;DAMMF
«Ml-,
D'ANALYSE
HYDROGEOLOGIE
/Í
Sf
lOUIflt
Flgur*
D'EAU
er \
Ré». iM
P
mg/l
ehm*/cm
nO
ÎURKAlOff
ér
pH
l~..,...m,n
"^
Co
Mg " "^
Cl
«OOO
íüon
r
)0P 6 OOO
-[
j
-
SÜ4
'
-
Ú
'
<
Í
10 00Í» -
.
1
5
j
^
1
'
o
- UM
a
!
1-3
5
10 OOO
-
1
*
1
-
1
-
-
r
T
i|M
9
i
/
4
-
-
1
^
.
-
B
L
/
8
:;
1
7
1
-
,
\
.
IOO
J
-
3
\
î
*
-
'
"
-
4
-
3
~
ï
Jf.
_- 9
J
'OCO
/
-
-
3
1
\
-
Z9
~-
1
1
_i.
/
T
* --
\
i
a
\
E
1
J
-
5
E
lOOO
6
_
-
4
e
1000 /
t
-
7
-
ft
-
-
IM
}
+
/
1
/
Z
-
Z
"
lOM
'
3
\
~--
w
^ \ "^
90
COs
4
1000
3
_-
/:
1
1 OOO
~
]W>
5
j
/.
k
a
4
ï
\
-
9
-.;
*
-
n
9 4
Y
\
/
4
-
c»t.kM
(Co,V HCOV)
a
r
)M
Ê
1
'
1
a
:
T
/
3
3
-
-
l
-'- -
-
-
10
3
1
IOO
1
--
a
»
-
-
^^^.
100 --
9
4
'
-
1
-
I
-
1
-
7
>
*
^
--
3
-
ï
v^
\
4
,
*
IH
,
-
i
'
4
r
J
__
- --
a
4
3
3
-
-
3
1
1
-
(
-
/
t
4
?l«int il». RI
arbG^
9
3
9
I
-':
-
Z
-
J
;
~
* ~
I
-
8
T
-
-^
3
-
_
IU
i
9
E
~-
IH
7
-
IM
:
.:
7
-
_:
-^
1
e
IOO
*
9
--
5
-
_
'
100
s
3
10
3
Il
-
I1TÎ]
7
-
-T
ft
-
Ê
2
-
- B (rtcr Lull)
-E
100
»
1 êA
i
;
-
''
8
^^A 1 A r t /
^
!
3
000
7
h
A
3
s
1
^N^
T
NC
4
1
s
1
;
1
-
9
1, /
]
-
I- »
?
1
a
1W
t
5
-
â
;:
loca
i
-
9
-^
9
-:
«
-:
'
:
1
-
a
a
iV
-
^
."
'
-^
-
'
"
3
-
1
1
5
3
-
-
-
-
'
100
_
-
-
.
3
--
'
4
-
i
5
3
1
r
-=
a
-
1
-
'
4
-
3
^
-
-
-^
-
^
1
7
;
1
3
-
î
i
-=
a
.1-
0,9
o.f -È
:
3
3
10
C- 0,8
-
'J
-
-
0,1
3
'
-
4
9
0.9
-=
0.1
~
o.a
"5
::
3
l
a
4
3
-
-
0.6
0.3
10
r
:
0,4
8
-
7
-'
'
J
3
i
-
^
'
to
"
-
J
ï
0,9
-
-
m
e
7
-
z:
0,4
I
-
10
-
,
10
4
-
- 0,3
* -}
ï
-
'
1
/
:()
*
"
-
IS
.)
"
-
a
-^
7
-=
Z
IB
1
*
0.3
-
s
:
0.3
a
-i
i
r
:
J
Z
10
t
t
*
-
6
,
o,a
Il
-
10
-
a
-^
s
-
1
5
-'
-
i
0,1
3
(
'
;
i
4
1
.
':
:
-
:- b
* -
-
4
-I
7
0.1
3
a
rscj
/^/o. 9.^
LEGENDE
B.R.G.M.
DIAGRAMME
D'ANALYSE
HYDROGEOLOGIE
Na
Mg ^
8 000
I
.n
K
H
Homut
Réi. MC
P
mg/l
ehmi/cm
Figuré
DEAU
I M
Cl
8lkKAtOff
so.
-1
-1
IOO
5
3
-
-
lOOO
COj
(C03"+ HCOV)
- r
ï
6
-
1
(
.3
â
NO,
1000
Cl
KHaIIm.
NoLLi
tft.
Saua^
pH