Download Trithérapies anti VHC : mode d`emploi
Transcript
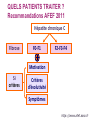
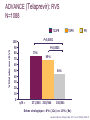
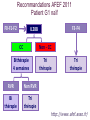
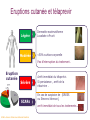
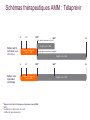
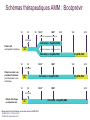
Trithérapies anti-VHC Modes d’emploi Denis OUZAN Institut Arnault Tzanck Saint Laurent du Var [email protected] Conflits d’intérêts Laboratoires Roche, MSD, BMS, Gilead, Janssen, Bohringer Ingelheim Déclaré par le Dr Denis OUZAN le 22 Novembre 2011 OBJECTIFS PEDAGOGIQUES : Connaître les résultats, les indications et les effets secondaires des inhibiteurs de protéases. Connaître et intégrer le polymorphisme de l’IL28B dans la prédiction de la réponse au traitement antiviral et la stratégie thérapeutique. Interféron pégylé et Ribavirine + Telaprevir ou Boceprevir Génotype 1 RVS chez les patients de génotype 1 naïfs traités par bocéprevir ou télaprevir Réponse virologique soutenue (%) 100 Δ ≈ 30 % 63-75 80 60 38-44 40 20 0 PegIFN/RBV BOC ou TVR + PegIFN/RBV Poordad F, et al. N Engl J Med. 2011;364:1195-1206 Jacobson IM, et al. N Engl J Med. 2011;364:2405-2416 QUELS PATIENTS TRAITER ? Recommandations AFEF 2011 Hépatite chronique C Fibrose F0-F1 F2-F3-F4 Motivation Si critères Critères d’évolutivité Symptômes http://www.afef.asso.fr ADVANCE (Telaprevir): RVS N=1088 % Malades avec RVS T12PR 100 90 80 70 60 50 40 30 20 10 0 T8PR PR P<0,0001 75% P<0,0001 69% 44% n/N = 271/363 250/364 158/361 Echec virologique : 8% (12s) vs 13% (8s) Jacobson IM et al. N Engl J Med. 2011 Jun 23;364(25):2405-16 ILLUMINATE (telaprevir): RVS en fonction de la durée du traitement chez les patients qui ont reçuT12PR (N=540) Durée du traitement en fonction de la eRVR 100 <20 SEM n=100 eRVR– 22% n=118 eRVR+* 60%* n=322 92 88 80 64 SVR (%) 18% RVS 60 40 23 20 Eligible à un traitement de 24 semaines et randomisés 24 contre 48 semaines* 48 semaines <20 semaines (en raison d’un arrêt prématuré) 0 eRVR+ T12 eRVR+ T12 PR24 PR48 eRVR– <20 sem T12 PR48 Sherman KE, et al. N Engl J Med 2011;365:1014–24 SPRINT-2 (boceprevir): (N=1097) PR48 PR Control lead-in n=363 Follow-up PR + Pbo SVR Sem 8–24 HCV RNA indétectable SVR Followup BOC RGT n=368 PR PIB HCV RNA détectable à partir de la sem 8 ,mais indétectable à la sem 24 PR + BOC Follow-up PR + Pbo BOC44 / PR48 n=366 PR PIB 0 Follow-up PR + BOC 4 8 Peg-IFN alfa-2b dose: 1.5 µg/kg/sem RBV dose: 600–1400 mg/jour Boc:12 gelules à 200mg/jour 28 24 Sem 48 SVR SVR 72 Poordad F, et al. N Engl J Med 2011;364:1195–206 SPRINT-2 : Traitement guidé par la réponse Durée de traitement 100 96 <28 semaines 28 semaines 34% 44% n=124 n=162 SVR (%) 80 RVS 72 60 40 48 semaines 22% n=82 28 semaines si ARN VHC indétectable aux semaines 8-24 48 semaines si ARN VHC détectable au moins à une reprise entre S8 et S24 mais indétectable à S24 15 20 0 28 semaines 48 semaines <28 semaines 156/162 59/82 18/124 <28 semaines (Arrêt en raison d’un ARN VHC détectable à S24 ou lié à effets secondaires) Poordad F, et al. N Engl J Med. 2011; 364:1195-1206 Phase de bithérapie initiale SPRINT-2 : RVS basée sur la réponse rapide à l’interféron Patients avec RVS (%) Tous les patients (cohorte 1 et cohorte 2) Diminution de la charge virale (log10) après 4 semaines dePIB Vierling JM. et al. EASL 2011. (abstract 481) RVS chez les patients caucasiens selon les réponses à S4 de la PIB 100 PIB = Phase Initiale de Bithérapie 82 80 82 RVS (%) Variants de résistance au Bocéprévir* 60 Baisse ≥ 1 logo10 52 39 40 29 BOC TGR 4% (9/232) BOC/PR48 4% (9/231) Baisse < 1 log10 20 0 5 121/234 3/62 48 P/R 187/228 21/73 BOC TGR 178/218 31/79 BOC TGR 47% (45/95) BOC/PR48 35% (33/94) BOC/PR48 Baisse ≥1 log10 de l’ARN-VHC par rapport à J0 Baisse <1 log10 de l’ARN-VHC par rapport à J0 Poordad F et al, N Engl J Med 2011;364:1195-206. Réponse virologique soutenue en fonction de l’IL28B – Fibrose F0-2 RVS* (%) 100 80 G1 naïf caucasien F0-F1-F2 83 12% 37% TT 60 CC 45 CT 33 40 20 Bithérapie 51% CC CT TT 0 Thompson AJ, et al. Gastroenterology 2010;139:120-9 La trithérapie résout-elle les risques d’échec liés aux facteurs de mauvaise réponse à la bithérapie ? SPRINT-2 Bocéprévir CC 80 78 82 CT CC CT 90 80 71 55 60 40 100 TT 80 65 RVS (%) TT 28 59 73 71 64 RVS (%) 100 ADVANCE Télaprévir 60 40 27 25 23 20 20 0 0 PR48 BOC BOC44/ PR48 BOC BOC44/ PR48 RGT PR48 RGT PR48 BOC BOC44/ RGT PR48 PR48 Zeuzem F, et al. Zeuzem F et al. abstract 12 EASL 2011. Jacobson IM, et al. Telaprevir for Previously Untreated Chronic Hepatitis C Virus Infection. N Engl J Med 2011;364:240516. T12PR PR48 T12PR Jacobson IM, et al. PR48 T12PR Télaprevir chez les malades G1 en échec Etude REALIZE % RVS 100 80 60 40 Absence d’impact de l’IL28B Rechuteur 88 85 85 Trithérapie CC IL28B Répondeur partiel 63 71 58 CT TT Répondeur nul 40 29 31 20 0 Pol S, et al. J Hepatol 2011;54(Suppl. 1):S6 Recommandations AFEF 2011 Patient G1 naïf F0-F1-F2 F3-F4 IL28B CC Non - CC Bithérapie 4 semaines Tri thérapie RVR Non RVR Bi thérapie Tri thérapie Tri thérapie http://www.afef.asso.fr/ RVS obtenue par le bocéprevir et le télaprevir chez les patients en échec thérapeutique 100 PegIFN + RBV 69-83 BOC ou TVR + PegIFN + RBV RVS (%) 80 40-59 60 40 29-38 24-29 7-15 20 0 Rechute Réponse partielle 5 14 F4 Réponse nulle Bacon BR, et al. N Engl J Med. 2011;364:1207-1217 Zeuzem S, et al. N Engl J Med. 2011;364:2417-2428 Vierling JM, et al. AASLD 2011. Abstract 931 Effets secondaires Télaprévir Anémie x 2 (32% vs 15%) Rash (55% vs 33%) Sévère 5% à 10% Bocéprévir Anémie x 2 ( 50% vs 25%) Dysgueusie (45% vs 18%) Prurit anal (26% vs 6%) McHutchison J et al, N Engl J Med 2009; 360 : 1827-38 Hezode C et al . N Engl J Med 2009; 360: 1839-1850. Jacobson IM et al. N Engl J Med 2011; 364: 2405-16. Zeuzem S, et al. N Engl J Med 2011;364:2417–28. Kwo P et al. Lancet 2010; 376: 705-716. Poordad F. N Engl J Med. 2011; 364:1195-1206. Bacon BR., et al. N Engl J Med 2011; 364:1207-1217.. Eruptions cutanée et télaprevir Légère Dermatite eczématiforme Localisée ±Prurit Modérée <50% surface corporelle Pas d’interruption du traitement. Eruption cutanée Sévère SCARs SCAR= Severe Cutaneous Adverse Reaction Arrêt immédiat du télaprévir. Si persistance , arrêt de la ribavirine . En cas de suspicion de (DRESS ou Stevens-Johnson), . arrêt immédiat de tous les traitements Telaprevir et anémie: RVS en fonction de la réduction de doses de RBV dans les essais ADVANCE et ILLUMINATE 100 SVR (%) 80 Réduction de dose de RBV 76 60 Absence de réduction de doses de RBV T12PR PR 72 54 41 40 20 0 n/N = 243/320 37/69 408/565 117/285 Poordad F, et al. DDW 2011. Abstract 626. Interactions médicamenteuses CYP 3A4/5 • Arrêt des médicaments à interaction • Pendant le traitement : information sur les médicaments contre-indiqués • Se référer à la rubrique des sites www.drugs.com/drug-interactions www.hep-druginteractions.org www.Pharmacoclin.ch INDICATION DU MÉDICAMENT NOM DE LA SUBSTANCE ACTIVE NOM COMMERCIAUX Alphabloquants alfuzosine Xatral®, Urion® Antiarythmiques amiodarone, flécaïnide, propafénone, quinidine, Cordarone® Flécaïne®, Rythmol® Quinimax® Dérivés de l’ergot de Seigle dihydroergotamine, méthylergonovine Diergospray®, Ikaran®, Séglor®,Tamik® Gynergène caféiné®,Méthergin® Agent de motilité gastrointestinale cisapride Prepulsid® Inhibiteurs de l’HMG-CoA réductase Simvastatine Atorvastatine Zocor®, Lodalès®, Inegy® Tahor® Neuroleptiques Pimozide Orap® Inhibiteurs de la PDE-5 sildénafil Revatio®, Viagra® Antimycobactériens rifampicine Rifadine®, Rimactan®, Rifater® Produits à base de plantes millepertuis Mildac® (attention à la phytothérapie) Antiépileptiques carbamazépine, Tegretol®, Aparoxal®, Di-Hydan® phénobarbital,phénytoïne Schémas thérapeutiques AMM : Télaprévir S0 S4** S12** S48 S24** RVR : ARN-VHC indétectable à S4 et S12 PegIFN α-2b + RBV Patient naïf et rechuteur (sauf cirrhotique) Télaprévir 12 semaines + PegIFN + RBV PegIFN α-2b + RBV S0 Patient non répondeur cirrhotique Non-RVR : ARN-VHC détectable à S4 et/ou S12 S4** S12** Télaprévir12 12semaines semaines++ Télaprévir PegIFN++RBV RBV PegIFN ** Règles d’arrêt de la trithérapie en fonction du taux d’ARNVHC ) Si ARN-VHC ≥ 1000 UI/ml à S4 et S12 Si ARN-VHC détectable à S24 S48 S24** PegIFN α-2b + RBV Schémas thérapeutiques AMM : Bocéprévir S0 S4 S8 S12* S24* S28 S36 S48 ARN-VHC indétectable à S8 et S24 VICTRELIS Patient naïf (sauf patient cirrhotique) Victrelis® + PegIFN/RBV PegIFN/ RBV ARN-VHC détectable à S8 et non à S24 Victrelis® + PegIFN/RBV S0 S4 S12* S24* PegIFN/RBV S36 S48 VICTRELIS Patient en échec à un précédent traitement (sauf répondeur nul ou cirrhotique) PegIFN RBV S0 Victrelis® + PegIFN/RBV S4 S12* S24* VICTRELIS Patient cirrhotique ou répondeur nul PegIFN RBV • Règles d’arrêt de la trithérapie en fonction du taux d’ARN-VHC Si ARN-VHC ≥ 100 UI/ml à S12 Si ARN-VHC détectable à S24 Victrelis® + PegIFN/RBV PegIFN/RBV S48 Monitorage virologique PCR sensible (< 15 UI/ml) S0 Charge virale de départ S2 Prédiction réponse S4 Prédiction réponse – Réévaluation trithérapie-TGR S8 Prédiction réponse –TGR S12 Prédiction réponse – Règle d’arrêt S16 Suivi arrêt TPV S24 Règle d’arrêt si ARN détectable S 72 Guérison si ARN non détectable Traitement de l’hépatite chronique C : émergence de résistance ARN du VHC (log UI/mL) 8 7 IP + PegIFN + RBV 6 Perte de la réponse 5 4 3 2 Echappement V36M R155K Poussée 1 0 -6 0 2 4 6 8 24 12 36 42 48 54 Semaines Limite de détection 66 72 78 Règles d’arrêt de la trithérapie en fonction du taux d’ARN-VHC Telaprevir Si ARN-VHC ≥ 1000 UI/ml à S4 et S12 ARN-VHC détectable à S24 Boceprevir Si ARN-VHC ≥ 100 UI/ml à S12 ARN-VHC détectable à S24 Nouveaux antiviraux à action directe (AAD) chez les malades de génotype1naïfs Etudes de phase II : Antiviraux directs + PegIFN +RBV SVR (%) 100 80 60 40 20 75 63 83 71 85 68 85 65 86 71 84 61 83 50 38 56 42 76 53 0 1. Poordad F, et al. N Engl J Med. 2011. 2. Jacobson IM, et al. N Engl J Med. 3. Sulkowski M, et al. EASL 2011. Abstract 60. 4. Terrault N, et al. AASLD 2011. Abstract 79. 5. Vierling JM, et al. AASLD 2011. Abstract LB-17. 6. Fried M, et al. AASLD 2011. Abstract LB-5. 7. Manns MP, et al. AASLD 2010. Abstract 82. 8. Jacobson I, et al. EASL 2010. Abstract 2088. 9. Lawitz E, et al. EASL 2011. Abstract 445. 10. Pol S. ICAAC 2011. Abstract HI-376. 11. Flisiak R, et al. EASL 2011. Abstract 4. Daclatasvir (inhibiteur de NS5A) + asunaprevir (inhibiteur de NS3) ± pegIFN/RBV pendant 24 semaines Etude US SVR24 (%) 100 [1] 90 Etude Japonaise [2] Daclatasvir + Asunaprevir Daclatasvir + Asunaprevir + PR 90* 80 * Malades de genotype 1b 60 40 36 20 0 1. Lok A, et al. NEJM 2012. 2. Chayama K, et al. Hepatology 2011. N/A Schéma simple Une prise par jour + Peu de cps/jour Tout Oral Très efficace (NR & cirrhose) Durée courte Actif sur tout génotype Bien toléré POINTS FORTS 1. Les antiprotéases (telaprevir, boceprevir) sont réservées aux malades de génotype 1. 2. La détermination de l’IL28B chez les malades naïfs, à fibrose F0-F2 définit un sous groupe (CC) chez lequel une bithérapie est suffisante. 3. En dehors de ce cas particulier, la trithérapie est le nouveau traitement de référence de l’hépatite chronique virale C génotype 1. 4. Une réponse virologique rapide et étendue (44 à 63% des cas) permet, en l’absence de cirrhose de raccourcir la durée du traitement 5. La trithérapie génère des effets secondaires supplémentaires (anémie, dysgueusie, éruption cutanée),