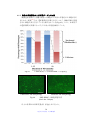
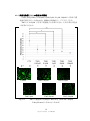
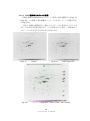
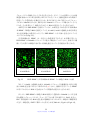
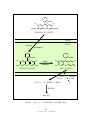
Download ファイルを開く - MIUSE
Transcript
平成 24 年度 修士論文 腹膜透析排液由来細胞の抗酸化能と老化 Anti-Oxidative Potential and Cellular senescence of Peritoneal Dialysis Effluent Derived Cells 三重大学大学院工学研究科 博士前期課程 分子素材工学専攻 阿部 功児 三重大学大学院 工学研究科 目次 1 諸言 ・ ・ ・ ・ ・ ・ 1 1.1 腎不全と腹膜透析療法 1.1.1 腹膜透析療法と合併症 1.1.2 腹膜透析液の pH とグルコース分解産物(GDPs) 1.1.3 腹膜透析排液 1.1.4 腹膜と腹膜中皮細胞 1.2 腹膜透析による酸化ストレスと抗酸化物質 1.2.1 酸化ストレス (ROS の生成) 1.2.2 抗酸化物質 (ROS の消去) 1.2.2.1 アスコルビン酸とその誘導体 1.2.2.2 トコフェロールとその誘導体 1.3 細胞老化 1.3.1 複製老化 1.3.2 腹膜透析療法と細胞老化 2 目的 ・ ・ ・ ・ ・ ・ 19 3 方法 ・ ・ ・ ・ ・ ・ 20 3.1 3.2 腹膜透析排液(PDE)からのヒト腹膜中皮細胞(HPMC)の分離 3.1.1 PDE の入手 3.1.2 HPMC の採取と培養 3.1.3 外挿法による初期接着細胞数の算出 間葉系幹細胞(MSC)の培養 3.2.1 抗酸化物質添加培地の調整 3.3 腹膜透析排液由来腹膜中皮細胞(PDE-HPMC)の細胞老化測定 三重大学大学院 工学研究科 3.4 PDE-HPMC の細胞内 ROS の測定 3.4.1 過酸化水素による DCF 感受性‐細胞内 ROS の測定 3.4.2 抗酸化物質添加による DCF 感受性-細胞内 ROS の測定 3.4.3 細胞内 ROS の定量化 PDE-HPMC の Cytokeratin-18, α-SMA 発現測定 3.5 3.6 二次元電気泳動 3.6.1 タンパク抽出 3.6.2 一次元目電気泳動 3.6.3 二次元目電気泳動 3.6.4 Flamingo による蛍光染色および画像解析方法 統計処理 3.7 4 結果 ・ ・ ・ ・ ・ ・ 29 4.1 腹膜透析排液由来細胞の初期接着率および細胞の形態観察 4.1.1 初期接着率の算出 4.1.2 細胞の形態観察および既報データとの比較 4.2 細胞老化測定 4.2.1 MSC での継代時の SA-β-Gal 染色 4.2.2 Senescence-Associated β-Galactosidase (SA-β-Gal) 染色 4.2.3 CAPD 期間との相関 4.3 細胞内 ROS 測定 4.3.1 過酸化水素による DCF 感受性-細胞内 ROS 測定 4.3.2 CAPD 期間との相関 4.3.3 抗酸化物質(AAG)の濃度依存測定 4.3.4 抗酸化物質(TMG)濃度依存測定 三重大学大学院 工学研究科 5 4.4 Cytokeratin-18, α-SMA タンパク発現 4.4.1 Cytokeratin-18 タンパク発現 4.4.2 α-SMA タンパク発現 4.4.3 CAPD 期間との相関 4.5 二次元電気泳動 4.5.1 抗酸化物質添加時でのタンパク発現の比較 4.5.1.1 AAG 添加時でのタンパク発現 4.5.1.2 TMG 添加時でのタンパク発現 考察 ・ ・ ・ ・ ・ ・ 45 5.1 PDE-HPMC の形態 5.2 細胞老化、形質変換マーカー(α-SMA)の発現およびその経路 5.3 細胞内 ROS 生成系と消去系 5.4 抗酸化物質 AAG, TMG の細胞内への取り込み機序 5.5 AAG, TMG 添加でのタンパク変動 6 結論 ・ ・ ・ ・ ・ ・ 60 7 今後の展望 ・ ・ ・ ・ ・ ・ 61 8 参考文献 ・ ・ ・ ・ ・ ・ 62 9 謝辞 ・ ・ ・ ・ ・ ・ 67 三重大学大学院 工学研究科 ・ ・ ・ ・ ・ ・ 68 11 APPENDIX A-1. 細胞培養プロトコール A-1-1. 培地調整 A-1-2. 腹膜透析排液由来細胞の分離 A-1-3. 継代培養 A-2. SA-β-Gal 染色 A-3. 細胞内 ROS 測定 A-4. 免疫化学蛍光染色 A-5. 二次元電気泳動 B-1. 滅菌について B-2. 本研究で使用した試薬について C-1. 腹膜透析排液サンプル結果まとめ(#1~#103) 三重大学大学院 工学研究科 1. 諸言 1.1 腎不全と腹膜透析療法 1.1.1 腹膜透析療法と合併症 腎機能が 30%以下になることを腎不全と言い、10%以下になると末期腎 不全となり透析療法が必要となる。腎不全の原因は以前までは慢性糸球体 腎炎であったが、現在では生活習慣の変化に伴い、糖尿病性腎症が原因 の 1 位となっている。 日本では、透析患者数は毎年 1 万人ずつ増加しており現在では約 30 万 人が透析療法を行っている。透析療法には大きく分類して血液透析 (Hemodialysis: HD) と腹膜透析 (Peritoneal Dialysis: PD) の 2 種類が存在 しており、本研究では腹膜透析に着目している。腹膜透析では、患者の腹 腔内に高濃度の D-glucose を浸透圧勾配形成物質として利用した透析液を 注入し、腹膜を介して拡散と限外濾過により水・老廃物の除去、電解質、pH の調整を行う治療法である。血液透析では、週に 3 回、1 回に 4~5 時間の通 院が必要となるが、腹膜透析は自分で行うことができる在宅治療であるため、 月に 1~2 回の通院で良い。また、腹膜透析は通常は 1 日に 3 回から 4 回行 うが、自己の残存腎機能の維持というメリットもあるため、導入初期には 1 日 1 回から始めることもできる。従って、血液透析に比べ、腹膜透析は就学や 就労がしやすく、必要な機材や薬剤が血液透析に比べ僅かですみ生産コ ストの面でも医療廃棄物処理の面でも設備投資がほとんど必要ないという面 など、経済効果が大きいこともメリットである。医学的にも、連続的な水・老廃 物除去による循環器系への負担軽減から、特に高齢者への適応がさらに広 がると期待されている。 しかし、腹膜透析では、透析液中の高濃度の D-glucose やグルコース分 解産物(Glucose Degradation Products: GDPs)や pH の影響による酸化ストレ スや溶質透過性、除水不足、さらに腹膜線維症、腹膜硬化症、腹膜肥厚な どの合併症が問題となっている[1][2]。そのため、腹膜機能を維持し、長期間 の PD 治療を可能にすることが大きな課題となっている。また、腹膜機能の 診断として、現在主に行われている診断法に比べ、簡便かつ無侵襲的な診 断方法の確立が急がれている。 1 三重大学大学院 工学研究科 1.1.2 腹膜透析液の pH とグルコース分解産物(GDPs) 腹膜透析と血液透析はほぼ同時期に治療が開始されている。医療機器 の開発は血液透析が猛烈な勢いで進歩した一方、腹膜透析は透析バッグ のプラスチック化程度の進歩であった。また、腹膜透析の透析液は主成分 の D-glucose の安定性の観点から 2000 年まではすべて酸性透析液であっ た。この酸性透析液を長期間使用すると、被嚢性腹膜硬化症(EPS)が発症 する可能性が高くなるということが示された [3]。これを避けるために、医師が 腹膜透析の新規導入を控え、血液透析の導入を進めることが腹膜透析の 低い普及率の原因であると考えられる。 しかし、その後 EPS の最も危険な因子は透析液の GDPs や pH であること が考えられ、2000 年ごろから中性透析液が研究・開発され、販売が開始さ れた。これにより、透析液の pH による影響はもちろん、GDPs の産生量も軽 減され(Table.1-1)、ダメージを与える危険因子を軽減することができ、腹膜 透析を長期間行うことが可能になりつつある[4][5]。 Table.1-1 酸性透析液と中性透析液の GDPs の比較 また、上記の D-glucose を浸透圧物質として主成分とする中性透析液の 他に、イコデキトリン(polyglucose; icodextrin)を浸透圧物質として用いる透析 液がある。イコデキストリン透析液においては、Glucose のポリマーであり、 Glucose のように体内に吸収されにくく、腹腔内での浸透圧勾配を長時間維 持することができる。除水量が少ない患者や除水が求められる際に使われ る透析液である。しかし、イコデキストリン透析液は pH が酸性に傾いている ため、これを改善することも課題であると考えられる。 2 三重大学大学院 工学研究科 現在使用されている腹膜透析液は D-glucose を使用したものが主であるが、 これは腹膜透析液には安価で容易に手に入りやすく、体内に吸収されても 分解できる浸透圧物質であることが理由である。D-glucose は安価であり、解 糖系によって体内で代謝されるメカニズムも知られている。そのため、1960 年代の腹膜透析療法初期から広く使用されてきた。透析液に含まれる D-glucose 以外の溶質は電解質である。代表的な透析液の電解質は Na+: 132mEq/L, Ca2+: 3.5mEq/L, Mg2+: 1.5mEq/L, Cl-: 96mEq/L, Lactate-: 35mEq/L である[6]。 D-glucose 水層では pH により安定性が異なり、pH が上昇するにつれて断 片化しやすくなる。一方で、pH を低く保つと分解を抑えられるが、エンジオ ールを経て、グルコソンを形成しやすくなる。また、酸性の透析液を腹腔内 にいれることで、被嚢性腹膜硬化症(EPS)などの合併症の危険性も高くなる。 従来の酸性透析液は pH を 5 前後にしていたが、2 液混合型の混合前の pH は 3 前後である。 D-glucose 透析液は腹腔内に貯留するため、滅菌処理が必要であり、酸 性下で滅菌している。現在の透析液の滅菌は一度に大量かつ確実、さらに 安価で安全に行うことができる高圧蒸気滅菌が主流である。しかし、加熱の 際に D-glucose が分解、断片化して GDPs が生成してしまう。GDPs のジカル ボニル化合物は反応性が高く、AGEs 形成促進や抗酸化タンパクの変性を 引き起こすことが報告されている[7]。GDPs はメチルグリオキサール、グリオキ サール、3-デオキシグルコソン、3, 4-デオキシグルコソン-3-エンなどが存在 する(Fig.1-1)。 3 三重大学大学院 工学研究科 Fig.1-1 GDPs 形成の経路 4 三重大学大学院 工学研究科 1.1.3 腹膜透析排液 腹膜透析は、腹腔内に高濃度の D-glucose を含む透析液を注入して浸 透圧濃度勾配により、水分や老廃物の除去を行っている。しかし、時間経過 により濃度勾配がなくなり、水分や老廃物の除去ができなくなる。そのため、 透析効率を維持させるために 1 日に 3~4 回透析液を交換する必要がある。 その際に生じるのが、腹膜透析排液である。この腹膜透析排液は 1 回に約 2 リットル、1 日に 4 回の透析液を注入するので、約 8 リットルの排液が 1 日に 生じる。また、この透析排液には透析によって体内から排出された水や老廃 物が主に含まれている。老廃物とは尿素、尿酸、クレアチニン(Cr)などであり、 ナトリウムイオン、カリウムイオン、カルシウムイオンといった電解質もバランス 調整され、透析排液中に含まれている。また、細胞成分としてマクロファージ、 リンパ球、好中球といった血球系の細胞や腹膜を構成する腹膜中皮細胞な どが含まれていることが、Betjes らによって報告されている[8][9](Fig.1-2)。 腹膜透析排液から得られる細胞や液性因子などからの情報は多く、腹膜 機能を診断する際にも利用され始めている。しかし、現在では採取した腹膜 中皮細胞の面積評価や赤血球の有無などの診断法しかなく、細胞機能で の診断法はないため、今後患者の腹膜機能を診断する際や、腹膜透析を 離脱する際の指標となる診断法の確立が必要となる。 Fig.1-2 腹膜透析排液に含まれる細胞群[8] 5 三重大学大学院 工学研究科 1.1.4 腹膜と腹膜中皮細胞 腹膜透析療法で生体半透膜として利用される腹膜は、腹壁の内面を覆う 壁側腹膜と腹部臓器を覆う臓側腹膜からなる漿膜組織である。この腹膜は たくさんの微絨毛を持つ単層の中皮細胞と、膠原繊維、弾性繊維、ヒアルロ ン酸などの細胞外マトリックスなどが存在する基底膜下の間質から構成され た生体複合膜である。間質組織中に線維芽細胞、脂肪細胞、肥満細胞、マ クロファージなどの細胞や毛細血管が散在する構造をとる。(Fig.1-3) 腹膜の表面積は成人で約 1.7~2.2m2、厚さは 50~150µm であるが、長期の 腹膜透析で肥厚すると約 500µm に至る。 Fig.1-3 正常な腹膜の形態学的模式図 腹膜中皮細胞(Human Peritoneal Mesothelial Cells: HPMC)は細胞単層を 形成する上皮系細胞である。腹膜中皮細胞は長さ 2~3µm、直径 0.08µm、 の微絨毛の厚い外套に覆われていて、微絨毛は細胞表面一面に一様に広 がっている(Fig.1-4)。微絨毛はリン脂質を分泌し、臓器間の癒着を防ぐ働き をしている。中皮細胞同士は斜めに重なり合い、固く組み合うように接着し ている。 Fig.1-4 正常中皮細胞の形態学的模式図 6 三重大学大学院 工学研究科 1.2 腹膜透析による酸化ストレスと抗酸化物質 1.2.1 酸化ストレス (ROS の生成) 生体内では呼吸によって得られる酸素は体内でエネルギーとして使われ る他に、一部は活性酸素(Reactive Oxygen Species: ROS)のスーパーオキシ ドアニオンラジカル(O2-)となる[10]。酸化ストレスとは、生体の内因性・外因性 の原因になり産生された ROS を処理できなくなった状態を示している。生体 は酸化ストレスに対してまず、適応するがそれができない場合は組織障害 や細胞死(アポトーシス)を引き起こす。しかし、生成した ROS は生体の抗酸 化酵素と呼ばれるものや、抗酸化物質と呼ばれる低分子化合物抗酸化作 用を持つタンパク質によって消去される。ROS の種類を下記の表に記す (Table.1-2)。 Table.1-2 活性酸素種(ROS)の種類と化学式 活性酸素ラジカル スーパーオキシドアニオンラジカル O2-・ ヒドロキシラジカル HO・ 過酸化ラジカル LOO・ アルコキシラジカル RO・ 活性酸素分子 過酸化水素 H2O2 1 一重項酸素 O2 過酸化物 LOOH 次亜塩素酸 ClOH 酸素錯体 鉄酸素錯体 また、透析液の D-glucose が細胞内に取り込まれた後、ROS を生成させる メ カ ニ ズ ム は 近 年 様 々 な 経 路 が 提 唱 さ れ て い る [10][11][12][13][14] 。 通 常 、 D-glucose は上記の酸素と同様にエネルギー源として細胞に供給され、細 胞質内で解糖によりピルビン酸を生成する。ピルビン酸はミトコンドリア内に 入り、クエン酸回路、電子伝達系を経て ATP を合成する。電子伝達系は ATP 生成(酸化的リン酸化)反応に必要なプロトン(H+)をミトコンドリアのマトリ ックスから膜間腔側へ汲み出す機能がある。その際に、ROS の一種のスー パ ー オ キ シ ド ア ニ オ ン ラ ジ カ ル (O2-) を 生 成 さ せ る こ と が 知 ら れ て い る [15][10] (Fig.1-5)。 7 三重大学大学院 工学研究科 Fig.1-5 ミトコンドリアの電子伝達系と ROS 生成[10] 複合体Ⅰは NADH から始まり、複合体Ⅱはコハク酸から始まる。電子伝達体として機 能するユビキノン(Q)からの電子は複合体Ⅲを経てシトクロム c (Cyt c)に、次いで複合 体Ⅳを経て最終的に酸素に電子を伝達する。 このスーパーオキシドアニオンラジカルが始まりとなり、過酸化水素(H2O2) などが産生される。そして、ヒドロキシラジカルでは、細胞内の鉄イオンとフェ ントン反応(Fig.1-6)を起こし、ヒドロキシラジカル(・OH)を生成させる。このヒド ロキシラジカルは ROS の中でも特に強い酸化能力を持つ[16]。 Fig.1-6 フェントン反応 細胞が高濃度の D-glucose に曝されると解糖やミトコンドリアの代謝経路 が亢進する。また、その他にポリオキール経路、ヘキソサミン経路、プロテイ ンキナーゼ C(Protein Kinase C: PKC)活性経路、AGEs 形成経路の 4 つの 代謝経路も亢進すると報告されている[10]。ポリオール経路の代謝亢進は細 胞内のグルタチオンの抗酸化力を抑制する。AGEs 形成経路の代謝亢進は メチルグリオキサールやグリオキサールなどの GDPs の生成を増加させる。 その結果、AGEs 形成が促進し、反応副産物として ROS が生成する[17]。 PKC 活 性 経 路 の 代 謝 亢 進 は ジ ア シ ル グ リ セ ロ ー ル (Diacylglycerol: DAG)-PKC 活性誘導により NADPH オキシダーゼが活性化する。活性化し た NADPH オキシダーゼは O2-を生成させる[14]。NADPH オキシダーゼは貪 8 三重大学大学院 工学研究科 食細胞(好中球、単球/マクロファージ、好酸球)が生体防御のために豊富に 所有している(Fig.1-7)。 Fig.1-7 貪食細胞 NADPH オキシダーゼの ROS 生成[18] 病原性微生物などの貪食時に O2-を生成する。O2-は不均化反応により過酸化水素 (H2O2)となる。さらに好中球顆粒から放出されたミエロペルオキシダーゼ(MPO)の作用 で次亜塩素酸(HOCl)へと変換される。また、O2-と過酸化水素の反応からヒドロキシラ ジカル(・OH)を生成させ、殺菌剤として働かせる。 1.2.2 抗酸化物質 (ROS の消去) 生体は ROS を免疫効果や血圧の調整などに利用し、恒常性を維持して いる。細胞や組織内で ROS の生成系と消去系のバランスを保つことは生命 の維持に繋がっている。生体は生成した ROS を抗酸化酵素(Superoxide dismutase: SOD、グルタチオンペルオキシダーゼ、カタラーゼなど)により消 去するシステムを所有している。ミトコンドリアや細菌が所有する SOD はマン ガンを含む 4 量体酵素であり、真核生物が有する SOD は銅と亜鉛イオンを 含む 2 量体酵素である。O2-は Cu, Zn-SOD が触媒するとほぼ拡散律速まで 反応速度が増大するほど効率よく機能している [19]。生成した過酸化水素も 速やかにグルタチオンペルオキシダーゼやペルオキシレドキシンによって 無毒化される(Fig.1-8)。 9 三重大学大学院 工学研究科 Fig.1-8 ROS 消去系のメカニズム[18] XO: キサンチンオキシダーゼ、SOD: スーパーオキシドジスムターゼ、Cat: カタラーゼ、 MPO: ミエロペルオキシダーゼ、GPX: グルタチオンペルオキシダーゼ、 GR: グルタチオンレダクダーゼ、TR: チオレドキシンレダクダーゼ、 PRX: ペルオキシレドキシン、GSH: 還元型グルタチオン、GSSG: 酸化型グルタチオ ン、 oxTRX: 酸化型チオレドキシン、redTRX: 還元型チオレドキシン しかし、生体の ROS 消去能力を超えた ROS が生成すると、ROS は脂質、 DNA、タンパク質にランダムに攻撃する。連鎖的酸化反応による細胞膜の 破壊や DNA の酸化的損傷による点変異、またはタンパクの変性や酵素の 失活といった酸化的障害を与える。以下に酵素の抗酸化物質と非酵素の抗 酸化物質を示す(Table.1-3)。 10 三重大学大学院 工学研究科 抗酸化物質とその機能 Table.1-3 酵素 抗酸化物質 機能 スーパーオキシドジスムターゼ (SOD) O2-除去 カタラーゼ H2O2 除去 グルタチオンペルオキシダーゼ H2O2 除去、LOOH 除去 グルタチオン-S-トランスフェラーゼ LOOH 除去 ペルオキシダーゼ H2O2 除去 ラジカルの補足 ビタミン C (O2・-, ・OH, 1O2, H2O2) ラジカルの補足 (脂質の酸化的連鎖反応の ビタミン E 停止) 非酵素 グルタチオン ラジカルの補足 (O2・-, ・OH, 1O2) 尿酸 ・OH, 1O2, HOCl 除去 アルブミン ・OH, HOCl 除去 1.2.2.1 アスコルビン酸とその誘導体 生体内の必須な抗酸化物質にビタミンがある。不足すると食物から取り込ん だ栄養素を生体に必要な物質にうまく転換できなくなり、体に様々な影響を 与える。ビタミンは 13 種類存在し、その性質から脂溶性と水溶性に分類され る(Table.1-4)。 Table.1-4 水溶性 各種ビタミンとその働き ビタミンの種類 化学名 主な働き ビタミン B1 チアミン 糖代謝を促進 ビタミン B2 リボフラビン エネルギー代謝と物質代謝に関与 ビタミン B6 ピリドキシン アミノ酸とタンパク質代謝に関与 ビタミン B12 コバラミン 赤血球精製や神経細胞の修復 ビタミン C アスコルビン酸 抗酸化作用、コラーゲン生成、 メラニンの抑制 葉酸 プロテイルモノ グルタミン酸 ビタミン B12 と共に赤血球生成や 神経細胞の修復 11 三重大学大学院 工学研究科 糖質・脂質・タンパク質の代謝、 エネルギー産生促進 ナイアシン酸 ビタミン H ビオチン 脂肪酸やアミノ酸の代謝の促進 脂肪酸など、体の構造成分の合成 と分解を促進、脂肪の代謝 パントテン酸 ビタミン A レチノール 皮膚や粘膜の細胞の正常な文化 を促進、粘膜の産生に関与 ビタミン D カルシフェロール 小腸からのカルシウムとリンの吸収 の補助 ビタミン E トコフェロール 抗酸化作用 (過酸化脂質の増加を抑制) ビタミン K フィロイキン 血液凝固因子を活性化、骨に存 在するオステオカルシンの活性化 脂溶性 アスコルビン酸(Ascorbic Acid: AA)はコラーゲンの生合成や鉄の吸収促進 などの生理作用があり、最も顕著な化学的性質は還元剤(電子供与体)とし て作用する能力である。この還元作用の範囲は広く、スーパーオキシドアニ オンラジカルや過酸化水素、一重項酸素だけでなく、ROS の中でも最も反 応性の強いヒドロキシラジカルをも消去する非常に優れた抗酸化物質である。 糖尿病動物の組織中では AA レベルが低くなることが報告されているが、こ れは糖尿病を特徴づける高血糖と過酸化が AA の減少を引き起こしたと考 えられている[20]。このことからも AA による抗酸化作用は、病気から生体を守 る上で非常に重要な役割をしていることがわかる。 AA の還元機構を Fig.1-9 に示した。AA は 1 個の電子を供与すると、モノ デヒドロアスコルビン酸を生成する。これらはさらに酸化されてデヒドロアスコ ルビン酸(DHA)を生成する。DHA は不安定な構造のため、容易にかつ不 可逆的にラクトン環を開き、2,3-ジケト-L-グロン酸を生成する。その後、非常 に複雑な経路を経て速やかに分解し、シュウ酸と L-スレオニン酸になる。ま た、DHA の分解産物であるシュウ酸は生体にとって好ましいものではないた め、グルタチオン(GSH)を用いて DHA を AA へと還元させる機構を有してい る。 12 三重大学大学院 工学研究科 Fig.1-9 AA の抗酸化機構 DHA は AA よりも若干脂溶性であるため細胞外へと取り込まれやすいが、 AA 自身は血中でほとんど酸化されないため細胞外では大部分が AA の形 で存在し、特異的な輸送メカニズムによって取り込まれる。AA は細胞膜上 の SVCT(soudium-dependent vitamin C transporter)という膜輸送体を介して 細胞内に取り込まれることが分かっている[21][22]。一方で、DHA の細胞内輸 送メカニズムは古くから研究されており、その構造が D-glucose と類似するた め、膜上の GLUT(glucose transtorter)からも多く取り込まれることが分かって いる[23][24](Fig.1-10)。細胞内に取り込まれた DHA は AA に還元され、抗酸 化作用を発揮する。一般に ROS が産生されやすい組織、例えば紫外線の 影響をうけやすく ROS が産生しやすいとされる角膜や水晶体、細胞内での 主要な ROS 産生源の場であるミトコンドリアなどには抗酸化物質も豊富に含 まれている。特に AA の生体内の分布は、脳下垂体、副腎、黄体などで高 い。一方、筋組織では低く、膵臓、肝臓、肺、脾臓、胸腺、腎臓はそれらの 中間である。 13 三重大学大学院 工学研究科 Fig.1-10 AA と DHA の細胞内取りこみ機構 また、アスコルビン酸の誘導体であるアスコルビン酸 2 グルコシド (Ascorbic Acid 2-Glucoside: AAG)は CGTase(cyclomaltodextrin glucanotransferase)という酵素を触媒に AA と α-シクロデキストリンを混合して 反応させることで合成される[25](Fig.1-11)。AA の 2 位 C に D-glucose がグリ コシド結合した構造で、分子量 338.27 の白色の結晶性固体である。 Fig.1-11 Ascorbic acid 2-glucoside (AAG)の合成 14 三重大学大学院 工学研究科 AA は安定性が低く、空気に触れることで酸化され、水に溶けるとその活 性を失ってしまう。しかし、AAG は AA に比べて熱や酸化、光、重金属に対 して極めて安定な物質である。生体内に適応すると細胞や組織に存在する 酵素(α-グルコシダーゼ)によって AA と Glucose(ブドウ糖)に分解されると考 えられている。 1.2.2.2 α-トコフェロールとその誘導体 α-トコフェロール(ビタミン E)は生体内細胞膜の酸化を防御する重要な役 割を担っている。血管細胞膜の酸化による硬化が進むと血行が悪くなり、肌 のつやなどが悪くなると考えられている。α-トコフェロールの長いアルキル鎖 は脂質に溶けるために重要であり、抗酸化作用はフェノール部分が受けも つ。細胞膜中に過酸化脂質ラジカルができた時に、α-トコフェロールラジカ ルでも、不対電子が π 共役系に広がることがフェノキシルラジカルの安定化 に重要な役割を果たしている。α-トコフェロールは過酸化脂質ラジカル (LOO・)のラジカルを速やかに補足して消去し、フェノール水素原子を渡し て、過酸化脂質ラ ジカ ルを 消去し 、自ら はフェノキ シルラ ジカルとなる (Fig.1-12)。α-トコフェロールのパラ位の酸素原子の p 軌道との共役が不対 電子軌道の分布を広げ、ラジカルの安定化に寄与している[16]。 Fig.1-12 α-トコフェロールの抗酸化反応 アスコルビン酸と α-トコフェロールは古くから生体内において重要な抗酸 化剤であることが知られていたが、近年、この両者の相乗的抗酸化作用が 重要視されている。脂質内で抗酸化反応によって生じた α-トコフェロールラ ジカルは、その境界面でアスコルビン酸により、元の α-トコフェロールに戻る。 すなわち、アスコルビン酸は α-トコフェロールを介在して細胞の酸化反応を 防御する役割を果たしている[16](Fig.1-13)。生体内組織には、一般にアスコ ルビン酸の方がより多く存している。 15 三重大学大学院 工学研究科 Fig.1-13 アスコルビン酸と α-トコフェロールの相乗的抗酸化作用[16] E: α-トコフェロール、C: アスコルビン酸、L: 脂質、 LOO: 過酸化脂質ラジカル、NAD: ニコチンアミド また 、α-トコフェロール の誘導体であるトコフェロールモノグルコシド (Tocopherol monoglucoside: TMG)は生体内での安定性が高く、水溶性があ り、微量で効果を発揮する(Fig.1-14)。また、透析液の浸透圧に影響しない、 蓄積性がない、炎症などを惹起しない、膜障害や腹膜肥厚を抑制するなど 腹膜透析療法への応用が期待される物質である。 Fig.1-14 TMG の構造 16 三重大学大学院 工学研究科 1.3 細胞老化 1.3.1 複製老化 ヒトの正常組織から単離した細胞は、培養環境下で有限の回数分裂した 後、増殖能力を失い、増殖を停止する。この有限分裂の限界はヘイフリック 限界と呼ばれ、ヘイフリック限界に達し増殖を停止した場合、これは複製老 化と呼ばれる。未分化細胞を除いた正常ヒト細胞では、染色体末端テロメア を伸長する酵素であるテロメアーゼを持たないため、合成期(S 期)にテロメア を完全に複製することが出来ず、増殖を重ねる結果、テロメアが短小化する (Fig.1-15)。短小化したテロメアは DNA 損傷部位を活性化し続け、その結果 細胞は増殖を停止する。テロメアーゼを強制発現させた正常細胞では細胞 分裂に伴うテロメアの短小化および DNA 損傷部位を活性化させないことか ら、複製老化はテロメア短小依存の細胞老化であると考えられている [26]。複 製老化によって細胞は、増殖能の低下とともに、細胞の肥大化、pH 6.0 条 件での β-ガラクトシダーゼ活性の増加やクロマチンの凝縮などの変化を示 すことが知られている[27]。 Fig.1-15 テロメア短小化概要 17 三重大学大学院 工学研究科 1.3.2 腹膜透析療法と細胞老化 細胞老化には先述した複製老化だけではなく様々なストレスによってテロ メア短小に依存しない細胞老化が起こることが知られている。これはストレス 誘導性早期老化と呼ばれ、in vitro における培養ストレスや酸化ストレス、ガ ン遺伝子の活性化といった様々なストレスによって誘導される。これらのスト レスの内、最も早期老化を誘導するストレスとして注目されているのは酸化ス トレスである。 ミトコンドリア電子伝達系でのエネルギー捕捉のためには、酸素分子の 4 電子還元を伴うが、中間産物として反応性が高い活性酸素種が同時に生じ る。活性酸素種は過酸化水素やヒドロキシルラジカルなどにも代謝され、生 体内の高分子と反応し、細胞に対して様々な機能劣化をもたらす。このよう な酸化ストレスに対して細胞はグルタチオンなどの抗酸化物質を産出して活 性酸素種を除去し、機能劣化を修復するような防御反応を示す。しかし、こ の防御反応を超過する酸化ストレスが蓄積した場合には、細胞はアポトーシ スや老化を示すことが示されている[28][29]。過度な酸化ストレスによって DNA 損傷がより多く蓄積しそれに伴って細胞老化を誘導する p53 タンパク質が活 性化されるという報告からも、ストレス誘導性早期老化が酸化ストレスに起因 するものと考えられる[30]。 腹膜透析療法においては浸透圧勾配形成物質として用いられている高 濃度の D-glucose 由来のストレス誘導性早期老化が亢進されているものと考 えられ、腹膜機能の低下の一因となっている可能性があると言える[31]。 18 三重大学大学院 工学研究科 2. 目的 腹 膜 透 析 排 液 中 に は 腹 膜 を 構 成 す る 腹 膜 中 皮 細 胞 (Human Peritoneal Mesothelial Cells: HPMC)が含まれていることが分かっている。透析液の主成分 である D-glucose は非生理的な濃度であることから、HPMC が過剰な酸化ストレス を受けて透析排液中に剥離してきていると考えられる。そこで、本研究では、排液 中に剥離してきた HPMC を分離し、キャラクタリゼーションを行うことで、患者の腹 膜状態を診断、または抗酸化物質の添加により新規腹膜透析液の開発への応用 を目的に実験を行った。 19 三重大学大学院 工学研究科 3. 方法 本研究で使用した試薬・機器に関する詳細なデータ、プロトコールに関して は、10. APPENDIX に示した。 3.1. 腹膜透析排液(PDE)からのヒト腹膜中皮細胞(HPMC)の分離 3.1.1. PDE の入手 本研究で使用した腹膜透析排液は、予め本学医学部倫理委員会によって 患者の腹膜透析排液の採取につき、承認を得て informed consent を得た患 者から頂いている。透析液の交換の際に腹腔内から排液したバッグから細胞 を採取した。 3.1.2. HPMC の採取と培養 実験に使用した腹膜透析患者は男性 12 名、女性 2 名であり、平均年齢は 71.56 (50-84)才、透析期間は 29.64 (1-71)ヶ月である。全患者情報は以下の Table.3-1 に示す。 Table.3-1 腹膜透析患者情報 20 三重大学大学院 工学研究科 <細胞分離・培養方法> 腹膜透析排液バッグに濾過滅菌した 5.0mmol EDTA / 5mL NaCl Solution (最終濃度 2.5mmol / L)をバッグのカテーテルからシリンジと針を用いて無菌 的に加え、排液全体に広がるようによく振り混ぜた。透析排液を遠心ボトル (TA-18)に移し、800r.p.m で 10 分間遠心分離した。上澄みを取り除き、30mL ほどを遠心管に移して再度遠心分離をかけ、1mL の細胞懸濁液になるまで 行った。その後、血球計算盤を用いて細胞数をカウントし、プラスチック培養 用 φ35mm シャーレに播種し、細胞培養用培地 10% FBS/M199 で培養した。 培地は 2,3 日に置きに交換した。 排液由来 HPMC の詳細な分離方法および使用器具・試薬は、APPENDIX に示した。 21 三重大学大学院 工学研究科 3.1.3. 外挿法による初期接着細胞数の算出 腹膜透析排液由来細胞は φ35mm シャーレで培養し、増殖の様子を位相 差顕微鏡(CK2, Olumpus, Tokyo, Japan)で観察し、デジタルカメラ CAMEDIA C-3040 ZOOM にてランダムに 4 ヶ所撮影し、PC に取り込んだ(Fig.3-1)。継時 的に画像を撮影し、細胞数をカウントすることで、グラフを作成し、その片対数 座標上の切片から初期接着細胞数を算出した(Fig.3-2)。 Fig.3-1 Fig.3-2 画像取り込みダイアグラム 初期接着細胞数の算出方法 22 三重大学大学院 工学研究科 3.2. 間葉系幹細胞(MSC)の培養 本研究で使用した間葉系幹細胞(MSC)は、理化学研究所バイオリソースセ ンターから購入した MSC を用いた。5000cells/cm2 で細胞を播種し、培地に 3ng/µL bFGF を添加した 10% FBS/DMEM を用いて φ35mm シャーレで培養 した。培地は 3 日に 1 回交換した。 3.2.1. 抗酸化物質添加培地の調整 添加した各抗酸化物質の濃度は以下の Table.3-2 に示した。 Table.3-2 Control AAG TMG 培地に添加する抗酸化物質の濃度 添加する AAG 濃度 添加する TMG 濃度 - - 25µM - 250µM - - 5µM - 50µM 3.3. 腹膜透析排液由来腹膜中皮細胞(PDE-HPMC)の細胞老化測定 老 化 細 胞 の 染 色 は 老 化 関 連 β-galactosidase (Senescent-Associated β-Galactosidase: SA-β-Gal) 染色キット (Sigma, Saint Louis, USA) を用いて 行った。 老化細胞では、pH 6.0 における β-Galactosidase 活性が増加しているため、 β-Galactosidase に反応する基質の X-Gal を加え、X-Gal の加水分解を触媒し、 青色に呈色することで老化細胞の検出を行う。 腹膜透析排液由来腹膜中皮細胞(PDE-HPMC)はセルディスク上で培養後、 培地を吸引し、PBS で洗浄し、固定液により細胞を固定した。固定液を取り除 き、再び PBS で洗浄した後、Staining Mixture を添加し、細胞が青色を呈する まで 37℃で約 15 時間インキュベートした(CO2 非存在下)。染色後、位相差顕 微鏡で細胞を観察し、染色された細胞と細胞数をカウントすることで SA-β-Gal 陽性細胞率を算出した。 詳細は 10. APPENDIX に記した。 23 三重大学大学院 工学研究科 3.4. PDE-HPMC の細胞内 ROS の測定 3.4.1. 過酸化水素による DCF 感受性-細胞内 ROS の測定 蛍光プローブ(DCFH-DA: 2’, 7’-Dichlorodihydrofluorescein diacetate)を用 いて、細胞内の ROS 生成状態を観察した。DCFH-DA は細胞膜を通過し細 胞内に存在する酵素のエステラーゼによって DCFH へと脱アセチル化される。 DCFH は ROS により速やかに酸化され蛍光物質の DCF を合成する(励起波 長 502nm、蛍光波長 520nm)[52][53]。ROS 生成のポジティブコントロールとして 過酸化水素を用い、DCF 感受性-細胞内 ROS 測定法のプロトコールを作成し た。 <方法> セルデスク上で PDE-HPMC をコンフルエントまで培養し、測定を行った。終 濃度 0.1mM 過酸化水素と終濃度 10µM DCFH-DA を同時に曝露し、暗所・ 室温下条件で 15 分静置した後に測定を行った。測定は走査型共焦点レーザ ー顕微鏡で行い、1well につき、ランダムに 4 ヶ所撮影をした。 走査型共焦点レーザーの設定条件は以下に示した。 <共焦点レーザー顕微鏡の条件設定> Table.3-3 走査型共焦点レーザー顕微鏡の測定条件 蛍光フィルター NIBA Dyelist Alexa Fluor 488 検出器の感度調節 (HV) 650HV Gain 1x Offset 0% レーザーの出力の調整 (Laser) 20% コンフォーカルアパチャー (C.A) 80um ハロゲンランプ調光 (Lamp) 2.9V Filter Mode Kalman Line 2 スキャン速度 2.0us / Pixel 画像サイズ 1:1, 512by 対物レンズ x 10, x 20 24 三重大学大学院 工学研究科 3.4.2. 抗酸化物質添加による DCF 感受性-細胞内 ROS の測定 セルデスク上で PDE-HPMC を抗酸化物質添加培地で 1 週間培養した。添 加した抗酸化物質は 250µM の Ascorbic Acid 2-glucoside(AAG)、5µM の Tocopherol monoglucoside(TMG)である。また、それぞれの濃度依存測定を 行った場合には、AAG が 25µM、125µM、250µM、TMG が 0.05µM、0.5µM、 5µM、50µM である。その後、終濃度 0.1mM 過酸化水素と 10µM DCFH-DA を同時に曝露し、暗所・室温条件下で 15 静置した後に測定を行った。測定は 走査型共焦点レーザー顕微鏡で行い、1well につき、ランダムに 4 ヶ所撮影を した。 走査型共焦点レーザー顕微鏡の設定条件は Table.3-3 と同様に設定した。 3.4.3. 細胞内 ROS の定量化 撮影した画像は画像解析ソフト(Image J)を用いて数値化した。Image J に画 像を取り込み、カラースケールの画像をグレースケールにし、バックグラウンド 補正を行い、バックグラウンドの輝度を 0 にした。その後、Threshold を設定し、 細胞 1 つずつの解析を行った。 得られた数値の平均化を行い、それを 1 サンプルにつき 4 枚ずつ行い、こ れを 1 サンプルの蛍光強度とした。 詳細は 10. APPENDIX に記した。 25 三重大学大学院 工学研究科 3.5. PDE-HPMC の Cytokeratin-18, α-SMA 発現測定 PDE-HPMC の特異タンパク発現は免疫化学蛍光染色により測定を行った。 特異タンパクとして中皮細胞マーカーである Cytokeratin-18 および間葉系マ ーカーである α-SMA に着目した。免疫化学蛍光染色は生体材料化学研究 室の共通のプロトコールに従って行った。ここではその概略を記す。 PDE-HPMC をセルデスク上でサブコンフルエントまで培養し、培地を吸引 し、PBS で洗浄した後、アセトン/メタノールにより固定した。次に、1%BSA/PBS でブロッキングし、希釈倍率 1 : 200 で希釈した Anti-cytokeratin-18 mouse mono antibody (Funakoshi, Japan) 及 び anti-human smooth muscle actin antibody (Dako, Glostrup, Denmark) の 一 次 抗 体 溶 液 を 添 加 し 、 4 ℃ で overnight 反応させた。その後、1%BSA/PBS で 3 回洗浄し、希釈倍率 1 : 200 で希釈した二次抗体 Goat anti-mouse IgG(H+L) FITC conjugate antibody (Millipore, MA, USA)と反応させた。サンプルは走査型共焦点レーザー顕微 鏡(Fluoview FV1000, Olympus, Tokyo, Japan)により観察した。タンパク発現 率はそれぞれランダムに撮影された画像から少なくとも 100 個の細胞数をカウ ントすることにより測定した。 また、走査型共焦点レーザー顕微鏡の蛍光の測定は以下の設定で行っ た。 Table.3-4 走査型共焦点レーザー顕微鏡の設定値 Dyelist NIBA WIG 検出器の感度調節 (HV) 650HV Gain 1x Offset 0% レーザーの出力の調整 (Laser) 20% コンフォーカルアパチャー (C.A) 80um ハロゲンランプ調光 (Lamp) 2.9V スキャン速度 2.0us / Pixel 画像サイズ 1:1, 512by 対物レンズ x 10, x 20 26 三重大学大学院 工学研究科 3.6. 二次元電気泳動 二次元電気泳動は生体材料化学研究室の共通プロトコールに従い、行っ た。ここでは、簡潔にその概要を示す。詳細は 10. APPENDIX を参照。 3.6.1. タンパク抽出 φ35mm シャーレでコンフルエントまで培養した PDE-HPMC を PBS で 2 回 洗浄し、PBS を 1mL 入れた状態でセルスクレーパーをして細胞を集め、 5000rpm/4℃で 5 分遠心分離させた。その後、上澄みの PBS を完全に取り除 いて細胞の質重量を量り、その質重量に対して 4 倍量のタンパク抽出液を加 えた後、氷冷下で超音波破砕し、15000rpm/4℃で 20 分遠心分離した。 この上澄みを採取し、試料とした。 3.6.2. 一次元目電気泳動 前日にゲル膨潤液で膨潤させておいた一次元目のゲルストリップ (Immobiline DryStrio pH4-7NL, 18cm)を取り出し、一次元目ゲル電気泳動槽 にセットし、Milli-Q を染み込ませた電極用ろ紙を一次元目のゲルストリップゲ ルの両端にセットした。試料塗布用ろ紙に抽出した試料を染み込ませ、電極 用ろ紙の 1mm 離した場所にセットした後に、白金線の付いた電極とサンプル アタッチメントを取り付けた。その後、空気との遮断のため、シリコンオイルを約 150mL~200mL 流し込んだ。 電源装置とつなぎ、プログラム通り 18 時間の等電点電気泳動を行った。 等電点電気泳動のプログラムは以下に記した。 Table.3-5 等電点電気泳動の電圧値プログラム ステップ モード 設定電圧 設定電流 時間 1 V 500V 250mA 2:00M 2 SG 3500V 2mA 6:00M 3 SV 3500V 2mA 10:00M 4 SV 3500V 2mA ∞ 27 三重大学大学院 工学研究科 3.6.3. 二次元目電気泳動 一次元目の泳動が終わったゲルストリップを前日に作って置いた SDS 処理 液に入れ、30 分間振とうさせた後に、次にアルキル化処理液に入れ 15 分間 振とうさせた。 その間に、10%アクリルアミドゲルを二次元目電気泳動槽にセットした。 アルキル化が終了したゲルストリップの端を切り取り、二次元目のアクリルア ミドゲルの上にゲル面が内側になるように載せ、ゲルが浮き上がらないように ゲルストリップの上にシャークコームを載せた。 Tris-Glycine バッファーを陽極、陰極の両方に同じ高さになるように入れた。 その後、電源装置とつなぎ、最初は 20mA、その後は 30~40mA の定電流で 電気泳動を行った。 3.6.4. Flamingo による蛍光染色および画像解析方法 Flamingo ゲルステインは、翻訳産物であるタンパク質を解析する 1 つのツ ールである。二次元電気泳動で得たゲルを固定液で浸し、30 分振とうした。 Milli-Q で 3 回洗浄した後、10 倍希釈した Flamingo 染色液でゲルを浸し、1 時間振とうさせた。染色が終わり次第、Milli-Q で 1 回洗浄し、予め準備してあ ったクリアファイルに挟み、遺伝子実験施設の蛍光撮影機によりスポット検出 を行った。 二次元電気泳動を行って得られたゲルを解析するため、フルオロホレスタ ー3000 Ver3.1 を用いて画像解析を行った。また、2 つのゲル染色画像をマッ チングさせて比較するため、Progenesis PG200/PG220 解析ソフトウェアを使用 した。 3.7. 統計処理 統計的な有意性は StatView®-J 5.0(SAS 社)を使用した。Control に対する 優位性を出す際には、t 検定(対応あり)で試験を行い、Control 以外のデータ の比較の際には、t 検定(対応なし)で試験を行うことで確率値(P 値)の算出を 行い、P 値<0.05 を有意とした。 28 三重大学大学院 工学研究科 4. 結果 4.1 腹膜透析排液由来細胞の初期接着率および細胞の形態観察 4.1.1 初期接着率の算出 腹膜透析排液から分離した細胞のうち、培養用シャーレに接着した細胞の 割合は 3.1±3.1%であった(Fig.4-1)。 また、分離し接着した細胞は正常組織から分離した腹膜中皮細胞と同様な 玉石状の形態を示す細胞が多く確認された(Fig.4-2)。 Fig.4-1 PDE-HPMC の初期接着率 正常組織由来 HPMC PDE-HPMC Fig.4-2 PDE-HPMC と組織由来 HPMC の形態比較 (Scale bar: 200µm) 29 三重大学大学院 工学研究科 4.1.2 細胞の形態観察および既報データとの比較 腹膜透析排液から分離し接着した細胞は玉石状の形態を示す細胞が多く 見られた。既報[32]では、透析期間が長期になるにつれて、線維芽様の形態 を示す細胞が多く存在していると報告されている(Fig.4-3)。しかし、本研究で は透析期間が長期になっても玉石状の形態を維持していた。 Fig.4-3 CAPD 期間による PDE-HPMC の形態変化 Fibroblast-like Morphology Cobblestone-like Morphology Fig.4-4 PDE-HPMC の細胞形態写真 (Scale bar: 200µm) 以上の結果は共同研究者(原 拓也)と共に行った。 30 三重大学大学院 工学研究科 また、3 回に 1 回の割合で酸性透析液の Extraneal を使用している患者群 と中性透析液のみを使用している患者群別にグラフ化すると酸性透析液を 使用した患者群でのみ線維芽様の形態を示す細胞の存在が確認された (Fig.4-5)。 Fig.4-5 使用透析液の違いによる PDE-HPMC の形態変化 31 三重大学大学院 工学研究科 さらに患者別に Fig.4-5 の結果を再グラフ化すると、亡くなった患者、また は腹膜透析を離脱した患者で線維芽様の形態を示す細胞が多く確認されて いることが示された(Fig.4-6)。グラフは、黄色の棒グラフ(左の 2 本)が中性透 析液のみの使用者であり、C, E が他界した患者、O のサンプルは入院中の 排液であった。 Fig.4-6 患者の違いによる PDE-HPMC の形態変化 32 三重大学大学院 工学研究科 4.2 細胞老化測定 4.2.1 MSC での継代時の SA-β-Gal 染色 老 化 細 胞 に お い て 、 pH 6.0 で 特 異 的 に 酵 素 活 性 を 示 す β-galactosidase(SA-β-Gal) で 老 化 細 胞 の 染 色 を 行 っ た 。 pH 6.0 で β-galactosidase 活性は老化細胞で容易に検出できるが、静止状態、不死化、 腫瘍細胞においては検出されない。 MSC は継代を重ねるごとに SA-β-Gal 陽性率が増加した。また、細胞の肥 大化が観察された。 P8, P15 において、AAG, TMG 添加での減少する傾向が見られた(Fig. 47)。 Fig.4-7 MSC での継代時の SA-β-Gal 陽性率 Tukey-Kramer; **: P<0.01, *: P<0.05 33 三重大学大学院 工学研究科 4.2.2 Senescence-Associated β-Galactosidase (SA-β-Gal)染色 老化細胞において pH 6.0 で特異的である老化関 連 β-galactosidase (SA-β-Gal)は P0 で染色を行い、患者毎の発現率をまとめた(Table.4-1)。 SA-β-Gal 陽性細胞が確認され、PDE-HPMC 中には老化が進行した細胞が 存在することが示された。 Table.4-1 患者毎の SA-β-Gal 陽性率 Fig.4-8 SA-β-Gal 染色画像 (Scale Bar; 200µm) 34 三重大学大学院 工学研究科 4.2.3 CAPD 期間との相関 また、CAPD 期間を 12 ヶ月以下と 13 ヶ月以上で分けて、患者平均の平均 化を行い、比較すると、CAPD 期間が増加するに従って発現率が有意 (p<0.01)に増加した(Fig.4-9)。長期間の腹膜透析液の曝露により、細胞の老 化が生じている可能性が示唆された。 Fig.4-9 CAPD 期間別での SA-β-Gal 陽性率の比較 Tukey-Kramer; **: P<0.01, *: P<0.05 35 三重大学大学院 工学研究科 4.3 細胞内 ROS 測定 4.3.1 過酸化水素による DCF 感受性‐細胞内 ROS 測定 下図(Table.4-2)に 0.1mM の過酸化水素による DCF 感受性‐PDE-HPMC 内 ROS 測定の結果を示す。患者ごとに蛍光強度の変動が見られる。 Table.4-2 0.1mM H2O2 による DCF 感受性-細胞内 ROS 測定 36 三重大学大学院 工学研究科 4.3.2 CAPD 期間との相関 CAPD 期間を 12 ヶ月以下、13 ヶ月以上で分けて患者平均の平均化を行 い、蛍光強度を比較すると、CAPD 期間が増加するにつれて蛍光強度の増 加する傾向が見られた(Fig.4-10)。つまり、CAPD 期間に依存して抗酸化能 が低下するということが示唆された。 Fig.4-10 CAPD 期間別での蛍光強度の比較 Tukey-Kramer;**: P<0.01, *: P<0.05, n.s: Not Significant 37 三重大学大学院 工学研究科 4.3.3 抗酸化物質(AAG)の濃度依存測定 活性酸素産生抑制効果を持つ抗酸化物質(AAG)の濃度依存の測定を行 った結果を以下(Fig.4-11)に示す。横軸は対数軸である。濃度は、2.5µM, 25µM, 125µM, 250µM の 4 条件での測定を行った。 AAG は濃度依存的な効果が示されており、受動輸送の可能性が示唆さ れる。 Control AAG 250µM AAG 125µM Fig.4-11 AAG 25µM AAG 2.5µM AAG の濃度依存別細胞内 ROS 測定 (Scale bar: 200µm) Tukey-Kramer;**: P<0.01, *: P<0.05 38 三重大学大学院 工学研究科 4.3.4 抗酸化物質(TMG)の濃度依存測定 抗酸化物質(TMG)の 0.05µM, 0.5µM, 5µM, 50, µM, 500µM の 5 条件で濃 度依存測定を行った(Fig.4-12)。横軸は対数軸をとり、グラフ化してある。 TMG は、0.05µM の非常に低濃度でも効果が示され、それ以降も同程度 の効果が示された。 TMG 0.05µM Control TMG 5µM Fig.4-12 TMG 50µM TMG 0.5µM TMG 500µM TMG の濃度依存別細胞内 ROS 測定 (Scale bar: 200µm) Tukey-Kramer;**: P<0.01, *: P<0.05 39 三重大学大学院 工学研究科 4.4 Cytokeratin-18, α-SMA タンパク発現 本結果(Cytokeratin-18, α-SMA タンパク発現)は共同研究者(原 拓也)と共に 行った結果である。 4.4.1 Cytokeratin-18 タンパク発現 PDE-HPMC は中皮細胞マーカーである Cytokeratin-18 タンパクを患者、 サンプルに関することなく 98.2±2.2%の割合で発現が確認された(Fig.4-13)。 この結果より、PDE-HPMC が腹膜中皮細胞であることが示されている。 Fig.4-13 患者別 Cytokeratin-18 タンパク発現 40 三重大学大学院 工学研究科 4.4.2 α-SMA タンパク発現 間葉系マーカーである α-SMA タンパクは PDE-HPMC で 28.2±10.7%の 細胞で発現みられた(Fig.4-14)。このことより、PDE-HPMC 中には上皮‐間葉 系形質変換(Epithelial to Mesenchymal Transition: EMT)を受けた細胞が混 在していることが示された。 Fig.4-14 患者別 α-SMA タンパク発現 41 三重大学大学院 工学研究科 4.4.3 CAPD 期間との相関 また、透析期間を 12 ヶ月で分けて α-SMA タンパク発現をみると、陽性率 は変化しないということが示された(Fig.4-15)。透析液の酸化ストレスを受け、 継続的に EMT が生じている可能性が示唆された。 Fig.4-15 CAPD 期間別での α-SMA タンパク発現の比較 Tukey-Kramer;**: P<0.01, *: P<0.05, n.s: Not Significant 42 三重大学大学院 工学研究科 4.5 二次元電気泳動 4.5.1 抗酸化物質添加時でのタンパク発現の比較 4.5.1.1 AAG 添加時でのタンパク発現 二次元電気泳動により、タンパク発現が各々500 スポットほど得られた。 (Fig.4-16, Fig.4-17)。この両者の染色画像をマッチングさせると、タンパク変 動が伺えた(Fig.4-18)。 Fig.4-16 Fig.4-18 Control Fig.4-17 AAG 250µM 添加 マッチング画像(Red: Control, Green: AAG 250µM) 43 三重大学大学院 工学研究科 4.5.1.2. TMG 添加時でのタンパク発現 抗酸化物質の TMG 添加時でのタンパク発現の変化を観察した(Fig.4-19, Fig.4-20)。この両者の染色画像をマッチングさせると、タンパク変動が伺え た(Fig.4-21)。 今後は、抗酸化物質添加で、酸化ストレスタンパクの増加はもちろんであ るが、それ以外の形態に関わるタンパクの発現などにも着目し、TOF/MS に よりタンパクの同定をする必要があると考えられる。 Fig.4-19 Fig.4-21 Control Fig.4-20 TMG 50µM 添加 マッチング画像(Red: Control, Green: TMG 50µM) 44 三重大学大学院 工学研究科 5. 考察 5.1 PDE-HPMC の形態 腹膜透析排液中に存在する腹膜中皮細胞(PDE-HPMC; Peritoneal Dialysis Effluent derived Human Peritoneal Mesothelial Cells)は、HPMC 特異的な玉石状 の形態を示す細胞が多く、存在率は約 3%であり、Betjes らの報告と同等の値で あった[8]。その他の細胞群は赤血球や白血球などの血球系の細胞であると考え られる。本研究で得られた PDE-HPMC は、PD(Peritoneal Dialysis)液の高濃度の グルコースやグルコース分解産物(Glucose Degradation Products: GDPs)により曝 され、酸化ストレスを受けていると考えられ、その結果として上皮-間葉系形質変 換(Epithelial to Mesenchymal Transition: EMT)や細胞老化が生じている可能性 が考えられる[30][31][33][34][35]。さらには、PD 液の pH により、細胞の Viability を低下 させるという報告[7]から、透析液の pH の影響も考えられる(Fig.5-1)。そこで、細胞 老化や EMT は透析液の高濃度のグルコースによる影響か pH による影響かを考 察した。 Fig.5-1 pH の違いによる HPMC の Viability[7] 本研究では、2003 年に報告された Mo らのデータ[32]よりも玉石状の形態を示 す細胞が多いことが示された(Fig.4-3)。そして、長期間 PD を続けても線維芽様の 形態を示す細胞が少なく、玉石状の形態を維持していることが示されている。こ れは、2000 年ごろから臨床使用されている中性 PD 液の影響が考えられる。 45 三重大学大学院 工学研究科 Mo らのデータ[32]は、中性 PD 液が使用されていない EU 圏であり、かつ 2003 年 以前のデータであることより、ほぼ全例が酸性 PD 液の患者サンプルを使用して いた。そのため、EMT を受けた HPMC が、PD 排液中に脱落してきたのではない かと考えられる。 しかし、本研究でも中性 PD 液を使用しているにも関わらず、線維芽様の形態 を示す細胞の混在も確認された。これは、約 4 回に 1 回の割合で使用されていた グルコースポリマーが主成分のイコデキストリン酸性 PD 液を使用していることが 原因の一つであると考えている(Fig.4-5)。イコデキストリンはグルコースのポリマー であり、浸透圧勾配を利用して体内から余分な水分の除去をする際に、通常のグ ルコースでは、体内に吸収され浸透圧勾配が徐々に減少してくるが、グルコース の高分子であるため、浸透圧勾配の維持ができ、腹膜の溶質透過性の亢進した 患者に使用することが多い。イコデキストリンは、酸性条件下で分解されにくいが、 pH を高くすると、細胞毒性の強い GDPs の産生が生ずる。また、体内にいれる液 体のため、滅菌が必要であり、一度に大量に滅菌することができる高圧蒸気滅菌 過程においても GDPs が産生されてしまう。 患者別に細胞形態を見ると、線維芽様の形態を示す細胞の出現確率の多い 患者と少ない患者が存在することが示された(Fig.4-6)。その中でも線維芽様の形 態を示す細胞の出現確率が多い患者は、C, E, O であった。C, E は、PD 治療中 に死亡した患者であり、さらに O は入院中のサンプルであった。 臨床データは少ないが、PD 期間中に臨床的なイベントが発生した際に、線維 芽様の形態を示す細胞の混在するのではないかと考えられる。PD は腹腔内に PD 液を注入するため、体内では異物として検出され、マクロファージが発生して いる。さらに、それに加えて腹膜炎などの臨床的なイベントが生じた際には、マク ロファージが大量に発生する。通常の場合では、細胞内で酸化ストレスと抗酸化 物質が平衡の状態であったが、臨床的なイベントが生じた場合では、マクロファ ージにより活性酸素種(ROS)が生成され、酸化ストレスと抗酸化のバランスが崩れ、 HPMC が酸化ストレスを受けている可能性が考えられる。その結果、EMT が生じ た HPMC が多く混在したのではないかと考えられる。 以上より、中性 PD 液により透析期間に依存することなく、細胞の形態が維持さ れることが示され、さらに線維芽様の細胞の出現により患者の腹膜状態の診断に 応用できる可能性が示唆された。 46 三重大学大学院 工学研究科 5.2 細胞老化、形質変換マーカー(α-SMA)の発現およびその経路 PDE-HPMC は、玉石状の形態を示す細胞が多く確認されたが、EMT を受け て線維芽様になった細胞や肥大化した細胞も観察された。PDE-HPMC 中に細 胞老化(SA-β-Gal)陽性細胞、形質変換マーカー(α-SMA)発現細胞が含まれる原 因として以下の 3 つが考えられる。 i. ii. iii. i. 高濃度のグルコースにより ROS が産生され、ミトコンドリア内で機能障害を 起こし、さらに ROS が蓄積されることで DNA が損傷を受ける。その結果、 p53→p21 の活性化に繋がり細胞周期が停止し、SA-β-Gal が陽性となっ た。 高濃度のグルコースにより TGF-β1 が産生され、p16 が活性化し、細胞周 期が停止して、SA-β-Gal が陽性となった。また、TGF-β1 のオートクリン/パ ラクリンによって、形質変換マーカーの α-SMA が発現した。 透析液の滅菌により GDPs が産生され、高い細胞毒性により細胞内の抗酸 化能が低下し、機能障害に陥り、細胞老化ならびに EMT を惹起させた。 ROS が蓄積されることで DNA 損傷して、p53 → p21 の活性化に繋がり細胞 周期が停止し、SA-β-Gal が陽性となる。 まず、本研究で行った SA-β-Gal 染色の妥当性を検討するため、間葉系幹細 胞(MSC)を用い、継代数と SA-β-Gal 陽性率を検討した。以前の研究結果[37]と同 様、本研究結果(Fig.4-7)においても、SA-β-Gal での染色により細胞老化を測定 することの妥当性が認められた。 以前の研究[38][39]より、本研究で得られた PDE-HPMC は、継代を繰り返すこと で細胞増殖能が低下し、同様に細胞面積も肥大化することが示されている。本研 究では得られた細胞を継代することなく SA-β-Gal の染色を行っていることから、 SA-β-Gal 陽性細胞の存在が細胞の老化、即ち、腹腔内の状態を判定する手段 になりえると考えた。患者の CAPD 期間の増加に伴い SA-β-Gal 陽性細胞が増加 していることが示されたが(Fig.4-9)、腹膜に存在している HPMC が長期間、高濃 度のグルコースに曝されていることが原因の一つと考えている。つまり、SA-β-Gal 陽性細胞の老化はテロメア短小の複製老化に、PD 液の酸化ストレスによる老化 が重畳した結果であると考えている[40]。 PD 液の成分である高濃度のグルコースは PKC 経路や NADPH oxidase を活 47 三重大学大学院 工学研究科 性化させて細胞内の活性酸素種(Reactive Oxygen Species: ROS)を増加させるこ とが報告されている[12][31]。また、ミトコンドリア内では解糖系の途中で ATP を産生 するが、その際にも ROS の一種であるスーパーオキシドアニオンラジカルが産生 される。つまり、中皮細胞層は ROS 産生の場となっている可能性は否定できない [31][40][41] 。さらに、高濃度のグルコースにより細胞内に存在する抗酸化物質である 還元型グルタチオンやグルタチオンペルオキシダーゼが抑制され、細胞内で ROS が蓄積されると考えられる[31]。ROS の蓄積により DNA 損傷が DNA 修復速 度を上回り、DNA 損傷が蓄積する。DNA 損傷が蓄積すると、p53 タンパクが活性 化され、次に p53 が p21 を活性化し、細胞周期が停止することが知られている [42] 。 ii. TGF-β1 により p16 が活性化し、細胞周期が停止することで SA-β-Gal が陽性と なる。さらに、TGF-β1 のオートクリン/パラクリンにより、α-SMA が発現。 細胞周期はサイクリン依存性キナーゼ(Cyclin Dependent Kinase; CDK)と、そ の機能を阻害するインヒビターにより調整されている。構造や機能の違いから 2 つ のグループに分類されているが、その中の Ink4 ファミリータンパク(p16, p15, p18, p19)は CDK4 および CDK6 とのみ結合する。このうち、p16 は CDK の活性を阻 害し、細胞周期を G1 期に制止させると考えられている。さらに、MAP キナーゼに より活性化される転写因子である Est1 および Est2 が p16 遺伝子の発現誘導に関 与することが示されていることから DNA 損傷とは異なる経路、即ち、腹膜透析療 法においては TGF-β1 の発現の増加によっても p16 が発現し、細胞老化が進行 することが考えられる[43][44][45]。 また、PDE-HPMC 中には間葉系マーカーの α-SMA タンパクを発現している細 胞も 30%程度確認された(Fig.4-14)。高濃度のグルコースにより HPMC は TGF-β1 が産生され、オートクリン/パラクリンで作用することが知られている[34][12]。つまり、 高濃度のグルコースによる酸化ストレスにより HPMC が EMT を受け、排液中に脱 落してきたと考えられる。HPMC から産生された TGF-β1 がオートクリン/パラクリン で作用し、Smad, ILK, PI3K/Akt 経路を通り、α-SMA タンパクを発現する[47][39]。 RhoA/ROCK 経路の活性化はストレスファイバー形成に関与しており、細胞形態 の再構築を引き起こす [48][49][50] 。さらに、細胞間結合の消失に伴ってアクチンが 脱重合して細胞内に遊離し、RhoA/ROCK 経路の活性化によって再重合した結 果、α-SMA ストレスファーバー形成を促進させたと考えられる。また、本研究室で も 10ng/mL の TGF-β1 を体網由来正常 HPMC に添加した際に α-SMA タンパク 発現が有意に上昇することを実験的に証明している[47](Fig.5-2)。 48 三重大学大学院 工学研究科 Fig.5-2 iii. 10ng/mL TGF-β1 曝露による α-SMA タンパク発現量の変化[47] GDPs により、抗酸化能が低下して機能障害に陥り、細胞老化ならびに EMT を惹起。 さらに、GDPs の関与も考えなくてはならない。PD 液は腹腔内に貯留するため に滅菌が必要となる。滅菌は、一度に大量の PD 液を滅菌し、安価で行うことがで きる高圧蒸気滅菌が採用されている。しかし、PD 液は高圧蒸気滅菌をかけること で GDPs が産生されることが知られている[7]。その中でも、特に細胞毒性の高いメ チルグリオキサールにより、細胞内の抗酸化能力を低下させ、細胞老化や EMT が生じていたと考えられる[62]。 さらに、メチルグリオキサールは AGEs の形成でも産生される。グルコースの分 解や AGEs 形成経路の促進により反応性の高いジカルボニル化合物を生成する。 通常、反応性の高いカルボニル基はアルデヒドレダクダーゼにより還元される。し かし、長期的にジカルボニル化合物がし続けると、アルデヒドレダクダーゼ自身も 糖化されて、酵素が不活性化されることが示されている[17]。 49 三重大学大学院 工学研究科 以上をまとめると以下のシグナル経路となると考えられる(Fig.5-3)。 Fig.5-3 高濃度グルコースによる細胞老化および α-SMA タンパク 発現上昇のメカニズム[12][31][37][40][41][42][43][44][45][47][48][49][50] 以上の 3 つの可能性から共通して示されていることは、PD 液の酸化ストレスに より細胞老化・EMT が惹起されているということが示され、以下のように関連して 作用している可能性が示された(Fig.5-4)。 Fig.5-4 PD 液による EMT 誘導と細胞老化の亢進の仮説[34] 50 三重大学大学院 工学研究科 5.3 細胞内 ROS の生成系と消去系 本研究で行った細胞内 ROS 測定は DCFH 感受性であり、その妥当性は本研 究室においても確認されている[51][52]。 本研究では透析期間ご とに細胞内の ROS 量が異なる結果が得ら れた (Fig.4-10)。これは、透析液の高濃度のグルコースが原因であることが考えられる。 実際に、透析期間が長期になると細胞内の ROS が増加する傾向が得られてい る。 前述したが、細胞内に取り込まれたグルコースは、ROS を生成させることが知ら れている。グルコースは、ミトコンドリア内に入り、電子伝達系で副次的に ROS を 生成させる[13]。さらに、NADPH オキシダーゼにより、PKC 経路を活性化させて ROS を生成させる[14]。この両者から生成される ROS はスーパーオキシドアニオン ラジカル(O2・-)である。生成した O2・-は、SOD(Superoxide dismutase)が触媒す る反応により速やかに過酸化水素になる。SOD は静電効果により O2・-を速やか に過酸化水素に変化させる構造をしている。例えば、Cu, Zn-SOD は、Glu132, Glu133, Lys136, Thr137 がポケット入口から Cu イオンと Arg143 側鎖の間の結合 部位まで水素結合のネットワークを作り、O2-を静電的に誘導している[19]。 続いて、グルタチオンレダクターゼやカタラーゼなどの酵素は過酸化水素を無 毒な水に分解して、ROS の影響を抑制している。 しかし、ROS 生成が増加し続ける状態では、SOD やグルタチオンレダクターゼ、 カタラーゼなどの酵素が ROS を消去しきれずに ROS 生成が ROS 消去を上回っ た結果、バランスが崩れて酸化ストレスとなる。 本研究室の研究結果では、透析液とほぼ同濃度の 200mM のグルコースを 6 時間以上曝露した際に ROS の増加傾向が確認されている。しかし、グルコースと 等浸透圧であるマンニトールでは、ROS の増加傾向は確認できなかった。これは、 51 三重大学大学院 工学研究科 グルコースによる酸化ストレスであると考えられる。さらに、この 6 時間というのは腹 膜透析療法の 1 回の貯留時間とほぼ同じである。しかし、腹膜透析は 6 時間後に 貯留している透析液の交換を行うため、体内に取り込まれて低くなったグルコー スがまた 200mM 注入され、繰り返し約 200mM のグルコースに曝されていること になる。その結果として、細胞内ではさらに ROS が増加していると考えられる。 本研究では PDE-HPMC を使用しているが、本研究室では以前に正常組織由 来 HPMC で細胞内 ROS を測定している。0.1mM と 1mM の過酸化水素を負荷さ せた蛍光画像の比較を行ったところ、PDE-HPMC の方が強い蛍光を示している ようにみられる(Fig.5-5)。 正常組織由来 HPMC は一度きりの負荷測定であるが、本実験で用いた PDE-HPMC は 200mM のグルコースに絶えず曝されていたことから、排液中に離 脱してきた際には細胞自身が持つ抗酸化能を失っている可能性が考えられる。 PDE-HPMC 0.1mM H2O2 Fig.5-5 正常組織由来 HPMC 0.1mM H2O2 正常組織由来 HPMC 1mM H2O2 PDE-HPMC と正常組織由来 HPMC での細胞内 ROS の比較 加えて、0.1mM の過酸化水素は 100mM のグルコースを曝露させた時と同程 度の ROS 産生量であるという報告がある[12]ことから、腹膜に存在している HPMC は常にこれ以上の ROS が生成されている間接的な裏付けともみなせる。 以上より、PDE-HPMC の細胞内 ROS 測定から透析液の 200mM という非生理 的な濃度のグルコースにより、ミトコンドリア内の電子伝達系での ROS 産生と、 PKC 活性経路による ROS 産生量が過剰量であったために、細胞内で機能障害 が生じ、細胞老化・EMT に繋がったと考えられる(Table.4-1, Fig.4-14, Fig.4-15)。 52 三重大学大学院 工学研究科 5.4 抗酸化物質 AAG, TMG の細胞内への取り込み機序 本研究では、AAG, TMG により細胞内 ROS を抑制する結果を得た(Fig.4-11, Fig.4-12)。実験では、過酸化水素と DCFH-DA を曝露する際には PBS で 2 回洗 浄した後に曝露用の培地に交換しているため、AAG, TMG が 0.1mM の過酸化 水素を曝露する際の培地に混入している可能性は僅かである。このことから、 AAG, TMG が細胞外の培地中で過酸化水素やヒドロキシラジカル消去している とは考えにくく、細胞内に取り込まれ、過酸化水素やヒドロキシラジカルなどの ROS を消去していると考えている。 AAG では、2.5µM、25µM、125µM、250µM の 4 条件での測定を行っており、 濃度依存的な効果が示されたことから、AAG は受動輸送である可能性が考えら れる(Fig.4-11)。トランスポーターなどの仲介輸送では、徐々に濃度依存的な効果 が見られなくプラトーになる。しかし、本研究の AAG では、濃度依存的に効果が 見られた。つまり、AAG は非仲介輸送(拡散)により細胞内に取り込まれている可 能性が考えられる。 AA(Ascorbic Acid)の細胞内への輸送メカニズムや代謝経路の解明はいくつか 報告があるが[21]、AA にグルコースを結合した AAG の輸送機構は詳しく分かって いない。細胞膜上に存在する SVCT(Sodium-dependent Vitamin C Transporter)と いうトランスポーターを介することで細胞内に輸送される[21][22][23][24]との報告もある。 SVCT は 12 回膜貫通型タンパク質で、SVCT1 と SVCT2 の 2 つの異性体があり、 高親和性で Na+の電気化学勾配を駆動力とする。SVCT1 は主に腸、腎臓、肝臓 などの上皮組織に含まれ、SVCT2 はその他の組織、脳や目、神経、内皮組織に 含まれることが知られている[22]。AAG は、AA 部位から SVCT を介し、細胞内に 取り込まれる経路が考えられる。また、AAG は AA の 2 位にグルコースが結合し ているため、細胞膜上に存在する GLUT (Glucose Transporter)を介して細胞内に 取り込まれるとも考えられる。つまり、AAG は SVCT, GLUT という 2 つのトランスポ ーターを介して細胞内に取り込まれる可能性が考えられる。しかし、本研究では 濃度依存的に取り込まれていることから、この経路以外の非仲介輸送(拡散)でも 細胞内に取り込まれたと考えられる。非仲介輸送で細胞内に取り込まれることで 濃度依存的に ROS を消去したと考えられる。 53 三重大学大学院 工学研究科 TMG では 0.05µM, 0.5µM, 5µM, 50µM, 500µM の 5 条件で測定を行った。 ROS は低濃度の 0.05µM で効果がみられ、それ以降も同程度の効果が示された (Fig.4-12)。Fig.4-12 は対数軸であるため、線形軸でとり、グラフ化すると以下とな る(Fig.5-6)。TMG では AAG とは異なり、プラトーになっている可能性が考えられ、 単純な受動輸送ではないことを表している。つまり、TMG は細胞膜上に存在する トランスポーターを介して細胞内に取り込まれると考えられる。 Fig.5-6 TMG の線形軸での濃度依存測定 TMG は、分子量 397 で Vitamin E の α-Tocopherol にグルコースが付加したも のである。α-Tocopherol は長いアルキル鎖があるため脂溶性であるが、TMG はア ルキル鎖の代わりにグルコースが付加しているため、水溶性である。しかし、抗酸 化能はフェノール基が受け持つので抗酸化作用を持ちつつ、水溶性に変化した 物質である。 TMG も AAG 同様、グルコースが付加しているためグルコース部位から GLUT を 通 過 す る こ と が で き る と 考 え ら れ る 。 さ ら に は 、 α-Tocopherol は α-TTP(α-Tocopherol Transfer Protein)を介して細胞膜を透過することができること も知られている[53][54][55]。α-TTP は肝細胞で発見されたが、現在では上皮細胞で も存在することも知られている。α-TTP は α-Tocopherol を認識し、チャネルがオー プンとなり、細胞内に取り込む(Fig.5-7)。従って、TMG は α-TTP を通過できると考 えられる。 54 三重大学大学院 工学研究科 α-TTP の構造とその取り込み方 (左: open、右: close)[55] Fig.5-7 N 末端ドメインの helix:緑、C 末端ドメインの helix:青、β-sheet:赤 C 末端ドメインは α-Tocopherol の結合ポケットを作る(左)。 その後、β-sheet が、底面を形成し、α-helix がシーリングする(右)。 α-TTP と α-Tocopherol はファンデルワールス力と水素結合ネットワークにより α-TTP のポケットの中で結合している。α-TTP の Val182 と Leu189 炭素原子は α-Tocopherol のクロマン環と 1 つの水分子を用いて水素結合相互作用で認識、 結合している。また、クロマン環のその他の原子、アルキル鎖の原子はファンデル ワールス相互作用により認識、結合していると考えられる(Fig.5-8)。 Fig.5-8 α-TTP のリガンド結合ポケットでの相互作用[55] α-TTP ポケット内の Val182, Leu189 が水素結合相互作用で結合(赤の点線) アルキル鎖、クロマン環のその他の原子はファンデルワールス相互作用で結合(緑の点線) 55 三重大学大学院 工学研究科 TMG は、GLUT と α-TTP の 2 つのチャネルを介して細胞膜に取り込まれる仲 介輸送と考えられる。さらに、本研究ではかなりの低濃度でも AAG よりも効果的 であった。これは、TMG が細胞膜の修復を行ったのではないかと考えられえる。 α-Tocopherol は脂溶性であり、細胞膜上で抗酸化作用を示す。TMG 自身にも α-Tocopherol と同じ抗酸化部位を持つため、細胞膜上で抗酸化作用を示した可 能性も考えられる。実際に、TMG と同様に α-Tocopherol の長いアルキル鎖を取り 除いた Trolox においても膜修復機能を持つということが報告されている [56][57]。 Trolox や TMG は水溶性であるため、膜のリン脂質の疎水性の部位では作用しな いと考えられるが、リン脂質の頭部である親水性で作用すると考えられる(Fig.5-9)。 このことより、TMG は 2 つのチャネルを介して細胞内に取り込まれる経路と、さら に TMG を添加している際に細胞膜のリン脂質の修復を行っていたと考えられる。 従って、細胞内と膜上で効果を示し、AAG よりも低濃度で効果が発揮されたので はないかと考えられる。 Fig.5-9 α-Tocopherol と Trolox のリン脂質での作用場所[57] (1: α-Tocopherol、2: Trolox) 脂溶性の α-Tocopherol はリン脂質の疎水基で作用するが、 水溶性の Trolox はリン脂質の親水基で作用し、膜修復を行う。 56 三重大学大学院 工学研究科 以上からまとめると、 AAG は、細胞膜上に存在する SVCT, GLUT を介して細胞内へ取り込まれる経 路と、非仲介輸送(拡散)により細胞内に取り込まれる経路が考えられる。TMG で も細胞膜上に存在する GLUT, α-TTP を介して細胞内へ取り込まれる経路が考え られる。さらに、TMG では細胞膜のリン脂質の頭部の親水性の部分に抗酸化作 用を発揮し、細胞膜の修復を行っていたと考えられる(Fig.5-10)。 Fig.5-10 AAG, TMG の取り込み機序の仮説 今後は、さらに多くの濃度条件を行うことで仲介輸送か非仲介輸送かどうかが 判明すると考えられる。さらに、SVCT, GLUT, α-TTP の阻害剤を用いることで明 確な作用機序の解明に繋がると考えられる。 57 三重大学大学院 工学研究科 5.5 AAG, TMG 添加でのタンパク変動 AAG, TMG 添加での二次元電気泳動から若干のタンパク変動が伺えた。本研 究ではタンパク同定を行っていないが、標的とするタンパクを絞り、既報のデータ [58][59][60][61] と比較することでタンパク変動を考察した(Fig.5-11, Fig.5-12)。 Fig.5-11 CTL vs. AAG のマッチング画像の拡大図 (Red: Control, Green: AAG 250µM) Fig.5-12 CTL vs. TMG のマッチング画像の拡大図 (Red: Control, Green: TMG 50µM) 58 三重大学大学院 工学研究科 既報の HPMC のデータと本研究の PDE-HPMC を比較することで、Fig.5-10, Fig5-11 で番号を付けた大きなスポットの照合ができた。以下に照合したタンパク を示す(Table.5-1)。 Table.5-1 2D 電気泳動で得られた可能性のあるタンパク質 スポット 1 では、β-Actin, Cytokeratin(CK)-8, -19 である可能性が示された。こ のスポットの中でもやや上にあるものが CK-8、中心あたりが β-Actin、やや下にあ るものが CK-19 であると思われる。スポット 1 の比較では、AAG, TMG 添加のどち らでも下が緑になっている。つまり、CK-19 のタンパク量が多くなっている可能性 が考えられる。その他の 2 つの β-Actin, CK-8 ではサチュレーションを起こしてい るため比較が困難である。さらに、スポット 2 では、CK-19 である可能性が高いと 考えられる。スポット 1 で得られた CK-19 とは若干分子量・pI が異なる。これは CK-19 のタンパク質がタンパク抽出の際などに分解を受け、分子量・pI が異なる スポットに発現したと考えられる。骨格系タンパクはタンパク量が多いため、このよ うなことが起こりやすいと考えられる。 また、スポット 3 はストレス応答の際に発現する HSP(Heat Shock Protein)27 である可能性があり、スポット 4 は、酸化還元タンパク質のグルタチオン-S-トランス フェラーゼである可能性が考えられる。 しかし、これらのスポットは TOF/MS を行っていないためにタンパクの同定は できていない。今後は既報のデータを参考にし、標的タンパクを決め、TOF/MS を行う必要があると考えている。また、AAG, TMG は抗酸化物質であるが、細胞 形態などの他の細胞機能にも作用している可能性も考えられるため、二次元電 気泳動はそれらのマーカーを見つけることができる可能性が示唆された。さらに は、現在の EMT マーカーに替わる早期診断マーカーの発見に繋がる可能性も 考えられる。 59 三重大学大学院 工学研究科 6. 結論 本研究より以下のことが示された。 ① 本研究で得られた PDE-HPMC は既報[32]と比較し、HPMC 特異的な玉石状の 形態を維持した。さらに、線維芽様の形態を示す細胞は酸性透析液 Extraneal 使用群のみで観察された。 ② PDE-HPMC には細胞老化が生じた細胞が混在していることが示され、透析期 間に依存して老化細胞が有意に増加することが示された。 ③ 細胞内 ROS 測定より、PDE-HPMC の抗酸化能は透析期間に依存して低下す る傾向が示された。 ④ AAG, TMG が細胞の抗酸化能をサポートすることが示された。また、濃度依存 測定より、AAG は SVCT, GLUT を介す経路と非仲介輸送(拡散)により細胞内 へ、TMG は GLUT, TTP,介して細胞内へ取り込まれる経路と、細胞膜上での膜 修復にも関与している可能性が示唆された。 本研究より、中性透析液の効果が明らかとなった。しかしながら、老化細胞・ EMT を受けた細胞が確認されている点から、今後は透析期間だけでなく、糖 尿病・合併症の有無などの他の臨床データと精査することで、患者の腹膜機能 の診断法へと繋がると考えられる。さらには、AAG, TMG の効果より、新規腹膜 透析液の添加剤として応用も期待できる結果となった。 60 三重大学大学院 工学研究科 7. 今後の展望 AAG, TMG の詳細な細胞内取り込み機序の解明 本研究では AAG, TMG の濃度依存測定により SVCT, GLUT, TTP などのト ランスポーターを介する経路と、非仲介輸送(拡散)による経路、膜修復による 経路であるというメカニズムの仮説を立てた。今後は、SVCT, GLUT, TTP を阻 害した場合の細胞内の取り込み試験を行い、明確にする必要がある。 この機序の解明により、新規腹膜透析液の添加剤としての応用へと繋がると 考えている。 HPMC のタンパク変動による診断マーカーの発見 本研究では、AAG, TMG 添加での二次元電気泳動でのタンパク変動を蛍 光染色にて観察・考察した。今後は、患者ごと、透析期間ごとでのタンパク変動 を観察し、TOF/MS をすることで変動タンパクの同定をする必要がある。 さらに、線維芽様の形質を示した細胞や TGF-β1 で EMT を誘導した細胞で の二次元電気泳動を行うことで、新規 EMT マーカーの確立、さらには早期診 断マーカーの発見に繋がると考えている。 腹膜機能の無侵襲診断法への確立 本研究では細胞形態、抗酸化能、細胞老化において細胞機能評価を行っ た。今後は更なる細胞機能評価や合併症などの臨床データとの相関を精査す ることで、細胞機能評価による患者の無侵襲な腹膜機能診断へと繋がると考え ている。 61 三重大学大学院 工学研究科 8. 参考文献 1. 平原 一郎,他.中皮細胞の epithelial-to-mesenchymal transition(EMT)による 腹膜肥厚の促進.腹膜透析.東京医学社(2007) 2. Williams JD, et al. Morphologic change in the peritoneal membrane of patients with renal disease. J Am Soc Nephrol. 2002; 13: 470-479 3. Nakamoto H, et al. New animal models for encapsulating peritoneal sclerosis—role of acidic solution. Perit Dial Int. 2001; 21: 349-53 4. 友 雅司.腹膜透析療法の変遷と展望.人工臓器 39 巻 1 号 2010 年 5. 中元 秀友.PD レジストリ 2011 年末調査報告-EPS 調査-.第 18 回日本腹 6. 7. 8. 9. 10. 11. 12. 13. 14. 膜透析医学会 学術集会・総会(2012) 飯田 喜俊,他.EBM 血液浄化療法.金芳堂(2000) 堀内 孝,他.腹膜細胞に及ぼす腹膜透析液中グルコース分解産物の影響. 臨床透析.2003; 19: 503-508 Betjes MGH, et al. The Mesothelial Cells in CAPD Effluent and Their Relation to Peritonitis Incidence. Perit Dial Int. 1991; 11: 22-26 Castro MF, et al. CELL POPULATIONS PRESENT IN THE NOCTURNAL PERITONEAL EFFLUENT OF PATIENTS ON CONTINUOUS AMBULATORY PERITONEAL DIALYSIS AND THEIR RELATIONSHIP WITH PERITONEAL FUNCTION AND INCIDENCE OF PERITONITIS. Perit Dial Int. 1994; 14: 265-270 Brownlee. Biochemistry and molecular cell biology of diabetic complications. Nature, 2001; 414: 813-820 Shostak A, et al. Cultured rat mesothelial cells generate hydrogen peroxide: a new player in peritoneal defense? J Am Soc Nephrol. 1996; 7: 2371-2378 Lee HB, et al. Reactivve oxygen species amplify protein kinase C signaling in high glucose-induced fibronectin expression by human peritoneal mesothelial cells. Kidney Int. 2004; 65: 1170-1179 Nishikawa T, et al. Normalizing mitochondrial superoxide production blocks three pathways of hyperglycaemic damage. Nature. 2000; 404: 787-790 Inoguchi T, et al. Protein kinase C-dependent increase in reactive oxygen species (ROS) production in vascular tissues of diabetes: role of vascular NAD(P)H oxidase. J Am Soc Nephrol. 2003; 14: s227-s232 15. 林 典夫,他.シンプル生化学.南江堂(2003) 16. 手老 省三,他.フリーラジカル-生命・環境から先端技術にわたる技術-.米 田出版(1999) 62 三重大学大学院 工学研究科 繁田 幸男,他.蛋白の糖化 AGE の基礎と臨床.医学書院(1997) 谷口 直之,他.酸化ストレス・レドックスの生化学.共立出版(2000) 田宮 信雄,他.ヴォート基礎生化学.東京化学同人(2004) Wu X, et al. Upregulation of sodium-dependent vitamin C transporter 2 expression in adrenals increases norepinephrine production and aggravates hyperlipidemia in mice with streptozotocin-induced diabetes. Biochem Pharmacol. 2007; 74: 1020-1028 21. Seno T, et al. Functional expression of sodium-dependent vitamin C transporter 2 in human endothelial cells. J Vasc Res. 2004; 41: 345-351 22. Tsukaguchi H, et al. A family of mammalian Na+-dependent L-ascorbic acid 17. 18. 19. 20. transporters. Nature. 1999; 399: 70-75 23. Corpe C P, et al. 6-Bromo-6-deoxy-L-ascorbic acid: an ascorbate analog specific for Na+-dependent vitamin C transporter but not glucose transporter pathway. J Biol Chem. 2005; 280: 5211-5220 24. Kc S, et al. Vitamin C enters mitochondria via facilitative glucose transporter 1 (Glut 1) and confers mitochondrial protection against oxidative injury. Faseb J. 2005; 19: 1657-1667 25. Aga H, et al. Synthesis of 2-O-α-D-Glucopyranosyl L-Ascorbic Acid by Cyclomaltodextrin Glucanotransferase from Bacillus stearothemophilus. Agric Biol Chem. 1991; 55: 1751-1756 26. 杉山 昌隆,他.蛋白質 核酸 酵素.2006; 51(1): 10-17 27. Dimri GP, et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proc Natl Acad Sci USA. 1995; 92(20): 9363-7 28. 五十嵐 和彦,他.生化学.2009; 81(6): 502-510 29. Parrinello S, et al. Oxygen sensitivity severely limits the replicative lifespan of murine fibroblast. Nat Cell Biol. 2003; 5(8): 741-7 30. Ksiazek K, et al. Oxidative stress-mediated early senescence contributes to the short replicative life span of human peritoneal mesothelial cells. Free Radic Biol Med. 2008; 45(4): 460-467 31. Ksiazek K, et al. Oxidative stress contributes to accelerated development of the senescent phenotype in human peritoneal mesothelial cells exposed to high glucose. Free Radic Biol Med. 2007; 42: 636-641 32. Yanez-Mo M, et al. Peritoneal dialysis and epithelial –to-mesenchymal transition of mesothelial cells. N Eng J Med. 2003; 348(5): 403-13 33. Ksiazek K, et al. Accelerated senescence of human peritoneal mesothelial cells exposed to high glucose: the role of TGF-β1. Lab Invest. 2007; 87(4): 345-56 63 三重大学大学院 工学研究科 34. Witowski J, et al. New Insights into the Biology of Peritoneal Mesothelial Cells: The Roles of Epithelial-to-Mesenchymal Transition and Cellular Senescence. Nephron Exp Nephrol. 2008: 108(4): e69-73 35. Witowski J, et al. Prolonged Exposure to Glucose Degradation Products Impairs Viability and Function of Human Peritoneal Mesothelial Cells. J am Soc Nephrol. 2001; 12(11): 2434-41 36. Ha H, et al. High glucose-induced PKC activation mediated TGF-beta 1 and fibronectin synthesis by peritoneal mesothelial cells. Kidney Int. 2001; 59: 463-47 37. 清水 佑典 著.アスコルビン酸と α-トコフェロールの誘導体の細胞老化に与え る影響.平成 23 年度 三重大学工学部分子素材工学科卒業論文 2012 38. Higashi Y, et al. Characterization of peritoneal dialysis effluent-derived cells: diagnosis of peritoneal integrity. J Artif Organs. 2012 39. 東 洋 著.腹膜透析排液由来細胞の分画および腹膜機の診断への応用.平 成 23 年度 三重大学大学院工学研究科博士前期課程分子素材工学専攻修 士論文 2012 40. Ksiazek K, et al. Premature senescence of mesothelial cells is associated with non-telomeric DNA damage. Biochem Biophys Res Commun. 2007; 362(3): 707-11 41. Ksiazek K, et al. Mitochondrial dysfunction is a possible cause of accelerated 42. 43. 44. 45. senescence of mesothelial cells exposed to high glucose. Biochhem Biophys Res Commun. 2008; 366(3): 793-9 Madan E, et al. Regulation of glucose metabolism by p53: Emerging new roles for the tumor suppressor. Oncotarget. 2011; 2(12): 948-57 Ohtani N, et al. Opposing effects of Ets and Id proteins on p16INK4a expression during cellular senescence. Nature. 2001; 409(6823): 1067-70 Takahashi A, et al. Mitogenic signaling and the p16INK4a-Rb pathway cooperated to enforce irreversible cellular senescence. Nat Cell Biol. 2006; 8(11): 1291-7 Takeuchi S, et al. Intrinsic Cooperation between p16INK4a and p21Waf1/Cip1 in the Onset of Cellular Senescence and Tumor Suppression In Vivo. Cancer Res. 2010; 70(2thre2): 9381-90 46. 杉本 昌隆,他.蛋白質 核酸 酵素.2006; 51(1): 10-17 47. Yamaguchi Y, et al. THREE-DIMENSIONAL INVASION OF EPITHELIAL-MESENCHYMAL TRANSITION-POSITIVE HUMAN PERITONEAL MESOTHELIAL CELLS INTO COLLAGEN GEL IS 64 三重大学大学院 工学研究科 PROMOTED BY THE CONCENTRATION GRADIENT OF FIBRONECTIN. Perit Dial Int. 2011; 31(4): 477-85 48. Maszi A, et al. Central role for Rho in TGF-beta1-induced alpha-smooth mucle actin expression during epithelial-mesenchymal transition. Am J Physiol Renal Physiol. 2003; 284(5): F911-24 49. Bhowmick NA, et al. Transforming Growth Factor-β1 Mediates Epithelial to Mesenchymal Transdifferentiation through a RhoA-dependent Mechanism. Mol Biol Cell. 2001; 12(1): 27-36 50. Fan L, et al. Cell Contact-dependent Regulation of Epithelial-Myofibroblast Transition via the Rho-Rho kinase-Phospho-Myosin Pathway. Mol Biol Cell. 2007; 18(3): 1083-97 51. 坂野 真利 著.活性酸素種による細胞間結合タンパクの非局在化に関する 研究.平成 18 年度 三重大学大学院工学研究科博士前期課程分子素材工 学専攻修士論文 2007 52. 松永 和也 著.培養細胞を用いた細胞内活性酸素種(ROS)産生とアスコルビ ン酸グルコシドによる ROS 消去能評価.平成 19 年度 三重大学大学院工学研 究科博士前期課程分子素材工学専攻修士論文 2008 53. Biesalski HK. Vitamin E Requirements in Parenteral Nutrition. Gastroenterology. 2009; 137(5): S92-104 54. Qian J, et al. Intracellular trafficking of vitamin E in hepatocytes: the role of 55. 56. 57. 58. tocopherol transfer protein. J Lipid Res. 2005; 46(10): 2072-82 Christopher Min K, et al. Structure and function of alpha-tocopherol transfer: implications for vitamin E metabolism and ANED. Vitam Horml. 2007; 76: 23-43 Howard AC, et al. Promotion of plasma membrane repair by Vitamin E. Nat Commun. 2011; 2: 597 Luzio M, et al. Antioxidant Activity of Vitamin E and Trolox: Understanding of the Factors that Govern Lipid Peroxidation Studies In Vitro. Food Biophys. 2009; 4(4): 312-320 Demir AY, et al. Proteome analysis of human mesothelial cells during epithelial to mesenchymal transitions induced by shed menstrual effluent. Proteomics. 2004; 4(9): 2608-23 59. Kratochwill K, et al. Stress Responses and Conditioning Effects in Mesothelial Cells Exposed to Peritoneal Dialysis Fluid. J Proteome Res. 2009; 8(4): 1731-47 60. Lechner M, et al. A Proteomic View on the Role of Glucose in Peritoneal Dialysis. J Proteome Res. 2010; 9(5): 2472-9 65 三重大学大学院 工学研究科 61. Lau AT, et al. A Proteome analysis of the arsenite response in cultured lung cells: evidence for in vitro oxidative-induced apoptosis. Biochem J. 2004; 382(Pt 2): 641-50 62. Hirahara I, et al. Methylglyoxal induces peritoneal thickening by mesenchymal-like mesothelial cells in rats. Nephrol Dial Transplant. 2009; 24(2): 437-47 66 三重大学大学院 工学研究科 9. 謝辞 本研究を行うにあたり、研究および研究生活全般において、適切かつ懇切なご 指導を賜り、公私において非常にお世話になりました三重大学大学院 工学研究 科 分子素材工学専攻 生体材料化学研究室の堀内 孝教授、宮本 啓一准教 授、事務員の村上 節子様に深く感謝致します。 本研究を行う上で必要な腹膜透析排液を提供していただいた患者様、そして、 そこに関わる三重大学医学部付属病院 血液浄化療法部の村田 智博先生、石 川 英二先生、そして、鈴鹿回生病院 腎臓センターの埜村 信介先生には、腹膜 透析排液の手配だけでなく、合同カンファレンスの中で大変貴重な臨床的な意見 を頂いたことにも深く感謝いたします。また、抗酸化物質の AAG, TMG を提供して いただいた大分大学医学部付属病院 腎臓内科の友 雅司先生にも深く感謝いた します。 そして、3 年間研究室の先輩として優しく、時には厳しく指導して下さった D3 水 谷 直紀先輩を始めとする諸先輩方、また大学院生活で公私ともに、励まし、刺激 し合い、共に成長した同期の神谷 歩君、境 淳志君、田野 裕美さん、中村 雅 広君、丹羽 一喜君に深く感謝致します。 さらに、M1 伊藤 直人君、影山 聡志君、小山 直紀君、中町 信敏君、長谷 川まりなさん、そして 1 年間ではありましたが、B4 角谷 優樹君、傍島 達也君、萩 原 慎之君、畑 俊宏君、古藏 史子さん、堀江 俊貴君、水田 裕磨君、山田 将 義君には様々な形でサポートしていただき、深く感謝致します。 また、本テーマを与えられた時より研究室生活から実験まで、厳しく、優しく指導 して私を成長させていただいた東 洋先輩を始め、同じ研究テーマを取り組み 3 年 間ともに研究し、お互い支え合い、刺激し合った同期の葛本 智淳君、原 拓也君、 そして後輩として実験のサポートや助言をしてくれた M1 清水 佑典君、叢 秀娜 さん、B4 西町 早織さん、山口 直也君には感謝の意が絶えることはありません。 心より深く感謝致します。 最後に、研究室生活や実験だけでなく、アメリカのクリーブランドクリニックへの留 学や国際学会での英語でのプレゼンテーション発表など、非常に貴重な経験を勧 めて下さった堀内 孝教授には再度、感謝致します。これら 3 年間の経験を糧に今 後もより一層精進していく所存です。 この素晴らしい研究室と、大変お世話になった皆様の今後のますますのご活躍、 ご発展することを心より願っております。 平成 25 年 3 月 阿部 功児 67 三重大学大学院 工学研究科 10. Appendix A-1. 細胞培養プロトコル A-1-1. 培地調整 A-1-2. 腹膜透析排液由来細胞の分離 A-1-3. 継代培養 A-2. SA-β-Gal 染色 A-3. 細胞内 ROS 測定 A-4. 免疫化学蛍光染色 A-5. 二次元電気泳動 A-6. 統計処理 B-1. 滅菌について B-2. 本研究で使用した試薬について C-1. 腹膜透析排液サンプル結果まとめ (#1~#103) 68 三重大学大学院 工学研究科 A-1. 細胞培養プロトコル A-1-1. 培地調整 <使用機器・器具・試薬> ・ 50ml シリンジ(TERUMO®) ・ 30ml アシストチューブ(アシスト/Cat.No.60.543.001S) ・ 注射針 ・ PH メーター ・ Millex-GV(MILLIPORE/Cat.No.SLGV025LS/孔径 0.22μm) ・ ・ ・ ・ Strivex GS(MILLIPORE/Cat.No.SVGSB1010/膜孔径 0.22μm) STERICUPTM フィルター(MILLIPORE/Cat.No.SCGVU05RE) 15ml 遠沈管 0.5ml アシストチューブ(アシスト/Cat.No.72.699 S) ・ ・ ・ ・ ・ ・ Medium 199(SIGMA/Cat.No.M2154) Penicillin streptomycin(SIGMA/Cat.No.P-0781) Insulin Transferin Selenate(SIGMA/Cat.No.I-1844) L-Glutamine(SIGMA/Cat.No.G-7513) Hydrocortisone(SIGMA/Cat.No.H-0888) 1N NAOH aq ・ 1N HCL aq(080-08065/Wako) ・ Fetal Bovine Serum(SIGMA/Cat.No.F9423) ・ Diethylpyrocarbonate <各溶液調整> ○ 培地調整 ・ ITS(Insulin Transferin Selenate) ITS(パウダー状)の瓶に DEPC 処理水 50 ml を入れ撹拌し、1.5ml ア シストチューブに 500μl ずつ分注し、冷蔵庫にて 4℃で保存した。 ・ L-G(L-Glutamine) 15 ml 遠沈管に 5 ml ずつ分注し、冷蔵庫にて 4℃で保存した。 ・ P-S(Penicillin-Streptomycin Solution) 5 ml アシストチューブに 5 ml ずつ分注し、冷凍庫にて-20℃で保存し た。 ・ HC(Hydrocortisone) HC 4 mg を 2 ml の無水 ethanol で溶解し、DEPC 処理水 2 ml を加えて 69 三重大学大学院 工学研究科 濾過した。0.5 ml アシストチューブに 200 µl ずつ分注し、室温で保存し た。 [操作] ① L-G、P-S 各 5 ml を一本のチューブにまとめ、L-G,HC をそれぞれ 50 µl ずつ加えた。 ② 上 記 の サ プ リ メ ン ト を 、 10 ml シ リ ン ジ ( TERUMO® ) を 用 い て Millex-GV を通してフィルター滅菌し、Medium-199 に添加した。 *pH を調整する場合 ③ 培地の pH を調整した。また、pH は 7.2 に調整した。 ※体内の pH は 7.4 である。 ※pH を 7.2 にするのは、フィルター滅菌後に pH の値がおよそ 0.2 大き くなるためである。1N-HCl aq や 1N-NaOH aq を使用して pH を調整 した。 ○ Fetal bovine serum(牛胎児血清)の不活性化、分注、保存 [操作] ① 凍結の状態で送られてきた FBS は 37℃で溶かした。溶かし終わった ら数回振り、55~56℃で、時折振り混ぜながら 30 分間温めた(不活性 化)。 ② 50 ml のシリンジ(TERUMO® )で吸い取り、Strivex GS、もしくは、 Stericup フィルターユニットにてフィルター滅菌し、30 ml アシストチュ ーブに 25 ml ずつ分注した。作業はクリーンベンチ内、滅菌操作で行 った。 ③ 冷凍庫(-20℃)で保存した。 ○ Trypsin-EDTA solution (10x) [操作] ① 納品後、冷凍保存(-20℃以下)した。 ② 37℃で解凍し、5 ml アシストチューブに 4 ml ずつ分注し、-20℃にて 保存した。 ○ 滅菌水の作製 [操作] ① Milli-Q 水又は蒸留水(用途に応じて)滅菌瓶に小分けし、高圧蒸気 滅菌(121℃、20 分)した。 ② 滅菌後、栓をしたまま棚に保管した。 70 三重大学大学院 工学研究科 ○ DEPC 処理水の作製 [操作] ① メディウムビンを Milli-Q 水で 2 回洗浄し、Milli-Q 水をメディウムビンに 入れた。 ② Milli-Q 水の体積に対して 0.1%の DEPC(Diethylpyrocarbonate)を加 え(500mlのミリ Q 水に対してならば DEPC を 500μl)、蓋をきっちり締め てよく振り混ぜた。 ※ DEPC は発癌性があるため、この作業は全てドラフト内で行うこと。 ③ そのまま 37℃のインキュベーター内に入れ、2 時間加温した。加温の 際には 30 分に 1 回振り混ぜること。 ※ 振り混ぜることでビンの蓋や首の部分、液体内に DEPC が均一に広がり、 全体の RNase を失活させる。 ④ ビンの蓋を十分緩めて、121℃/40 分(1 本あたり 500mlならば)オート クレーブにかけた。 ※ オートクレーブをすることにより DEPC を除去する。オートクレーブ後にも DEPC の臭いが残っている場合は、もう一度オートクレーブにかける。 ※ DEPC は発癌性であるため、むやみに蒸気を吸うことのないように気を付け ること。また、オートクレーブに溜まった水は気化して抜けた DEPC が溶け 込んでいるので、その排水は責任を持って処理すること(大量の水と共に排 水口へ流す)。 A-1-2.腹膜透析排液由来細胞の分離 〈使用機器・器具・試薬〉 ・ CO2 インキュベーター(池本理科工業/10-0212) ・ 遠心分離機(TOMY RX-200 生命科学研究支援センター) ・ 恒温槽 ・ Vortex ・ 遠心ボトル(TA-18) ・ 15ml 遠沈管(住友ベークライト株式会社/Cat.No.MS-56150) ・ ・ ・ ・ ・ 50ml 遠沈管(住友ベークライト株式会社/Cat.No.MS-56500) 遠沈管立て 10ml ピペット(住友ベークライト株式会社/Cat.No.MS-66100) ピペッター φ35mm シャーレ(住友ベークライト株式会社/Cat.No.MS-80240) 71 三重大学大学院 工学研究科 ・ ・ ・ ・ パスツールピペット スパチュラ 血球計算盤 カウンター ・ ・ ・ ・ Medium-199(SIGMA/Cat.No.M2154) PBS(SIGMA/D8537) EDTA(SIGMA/T4174) Fetal Bovine Serum(SIGMA/Cat.No.F9423) 〈組織の入手方法〉 本研究で用いた腹膜透析排液から分離した HPMC は、予め本学医学部倫理委 員会にて患者の腹膜透析排液の採取について承認を得ており、informed consent を得た三重大学病院透析室における患者より頂いた透析排液である。基本的に週 1 回排液を頂き、その都度サンプル番号(#数字)をつけた。 〈前日の準備〉 [操作] ① 遠心ボトル、はさみ、クランプをオートクレーブにかけて器具滅菌しておく。 ② 0.9% NaCl solution を調整し、5.0 mmol EDTA / 5 ml NaCl solution を濾過 滅菌しシリンジに入れておく。 〈細胞分離〉 [操作] ① 排液バッグから 10cm ほどのカテーテルを残して、注入側の透析バッグを切 り離す。この際に、メーカー、透析液の種類、液量を確認しておく。 ② 濾過滅菌した 5.0mmol EDTA / 5.0ml 0.9%NaCl solution を調整しておき、 排液 2L に最終濃度 2.5mmol/L になるようにシリンジを用いてカテーテルか らインジェクトし、無菌的に加える。 ③ EDTA 溶液が排液全体に行きわたるよう混ぜる。(EDTA 溶液は排液バッグ 内側に接着している細胞を剥がすためや、細胞の生理活性を上げるために 入れる。) 72 三重大学大学院 工学研究科 ④ 排液をよく混ぜたのち、遠心 ボ ト ル ( TA-18 ボ ト ル ) に 300~400ml ずつ分注し 37℃、 800rpm(50G)で 10 分間遠心 分離する。 (TOMY RX-200 生命科学 研究支援センター 3 階 加 賀谷先生) (この際に各ボトルの重量を求め、排液の総重量を算出する。) ⑤ 各遠心ボトルの上澄みを捨て、 排液を 30ml くらいまでにし、 50ml の遠心管に分注する。 ⑥ 各遠心管を 750~800rpm で 10 分間遠心分離し、 上 澄 み を 捨 て 、 15mL 遠 心 管 に 集 め 、 再 び 750~800rpm で 10 分間遠心分離する。 73 三重大学大学院 工学研究科 ⑦ 15mL 遠心管の上澄みを捨て、10%FBS/M199 培地を 1mL 加えて細胞懸濁 液を作成し、血球計算盤で細胞数をカウントする。 ⑧ 接着用 φ35 シャーレに 10%FBS/M199 を 加えて 37℃ / 5% CO2 でプレインキュベ ートしておき、細胞懸濁液を播種する。 (播種密度は 7~10×104 cells / cm2 が適度 だと思われるが、それ以下の場合は全細 胞数を播種するといい。) ⑨ 翌日、PBS で 3 回洗浄後に培地 10%FBS/M199 を交換する。 ⑩ 培地は 3 日に一回交換する。 A-1-3. 継代培養 <使用機器・器具・試薬> ・ CO2 インキュベーター(池本理科工業/10-0212) ・ ウォーターバス ・ ・ ・ ・ ・ ・ ・ ・ ・ Vortex 25cm2 培養フラスコ(住友ベークライト株式会社/Cat.No.MS-21050) 75 cm2 培養フラスコ(住友ベークライト株式会社/Cat.No.MS-21250) 6 穴プレート(友ベークライト株式会社/Cat.No.MS-80060) φ35mm シャーレ(住友ベークライト株式会社/Cat.No.MS-80240) 15ml 遠沈管(住友ベークライト株式会社/Cat.No.MS-56150) 50ml 遠沈管(住友ベークライト株式会社/Cat.No.MS-56500) 遠沈管立て 10ml ピペット(住友ベークライト株式会社/Cat.No.MS-66100) ・ ・ ・ ・ ・ ピペッター パスツールピペット チップ各種 セルスクレーパー(住友ベークライト株式会社/Cat.No.MS-93170) カウンター 74 三重大学大学院 工学研究科 ・ 血球計算盤 ・ ・ ・ ・ Medium-199(SIGMA/M2154) PBS(SIGMA/M8537) TRYPSIN-EDTA SOLUTION(10x)(SIGMA/T4174) Fetal Bovine Serum(SIGMA/Cat.No.F9423) <細胞の洗浄> [操作] ① 培養フラスコの蓋を開け、口元を加熱殺菌した。 ② 滅菌済み 10ml ピペットを加熱滅菌し培養フラスコ内に挿入し、培養液を吸引 した。 ③ PBS 溶液 5ml/25cm2 フラスコ又は 10ml/75 cm2 フラスコを添加し、前後左右に 振り洗浄した。 ④ 滅菌済み 10ml ピペットを加熱滅菌し培養フラスコ内に挿入し、洗浄液を吸引 した。 <継代作業> [操作] ① 冷凍保存してあるトリプシン 1ml に培地 9ml を加え、10 倍希釈した。(以下トリ プシン溶液) ② トリプシン溶液 5ml/25 cm2 フラスコ又は 10ml/75 cm2 フラスコを加え、37℃の CO₂インキュベート内にて 10 分間放置した。 ③ 顕微鏡で細胞が剥がれたことを確認後、FBS 1ml/25 cm2 フラスコ又は 2ml/75 cm2 フラスコを加えた。 ④ 滅菌済みセルスクレーパーを培養フラスコ内に挿入し、細胞を剥離した。 ⑤ 滅菌済み 10ml ピペットで培養フラスコ内の細胞懸濁液を吸引し、15ml 遠心管 に入れた。 ⑥ 50G(750rpm5 分間原則 4℃)遠心分離した。 ⑦ 培養フラスコに 10%FBS/M-199 を入れ、37℃の 5%CO₂インキュベート内にて 放置した。 ⑧ ⑥で遠心分離した上澄みをピペットで吸引した。 ⑨ 10%FBS/M-199 を 1ml 又は 3ml を遠心管に沈殿している細胞に加え、細胞 懸濁液を作成し、10 回ピペッティングを行った。 ⑩ 細胞懸濁液を取り、⑦で用意しておいた培養フラスコに 200μl/25cm2 フラスコ、 1ml/75cm2 フラスコ播種し、37℃の CO2 インキュベート内にて培養した。 75 三重大学大学院 工学研究科 A-2. SA-β-Gal 染色 [原理] Senescent Cells Histochemical Staining Kit は老化細胞を同定する素早い染色方 法に使用される全ての試薬が含まれる。β-galactosidase 活性の組織化学染色は pH6 に基づいている。これらの条件において β-galactosidase 活性は老化細胞で容 易に検出できるが静止状態、不死化、腫瘍細胞においては検出されない。 [試薬] ・Senescent Cells Histochemical Staining Kit (Cat.No. CS0030 / Sigma-Aldrich) Components ・Fixation Buffer 10x (Cat No. F1797) Solution containing 20% formaldehyde, 2% glutaraldehyde, 70 mM Na2HPO4, 14.7 mM KH2PO4, 1.37 M NaCl, and 26.8 mM KCl 15 ml ・Reagent B (Cat No. R5272) 400 mM Potassium Ferricyanide 1.5 ml ・Reagent C (Cat No. R5147) 400 mM Potassium Ferrocyanide 1.5 ml ・X-gal Solution (Cat No. X3753) 40 mg/ml 4 ml ・Staining Solution 10x (Cat No. S5818) 15 ml ・Phosphate Buffered Saline (PBS) 10x (Cat No P3621) 60 ml Preparation Instructions ※この手順における試薬の分量は 24well plates で 10tests 用である。異なる plates/wells では Appendix 1 に従って量を計算する。 76 三重大学大学院 工学研究科 ※使用前にキットの全てを解凍し、溶液が均質に溶けるまでよく混ぜる。 ※キットの溶液の調整には滅菌水を使用する。 ※X-gal Solution – 1 時間、37℃で X-gal Solution を温める。染色された細胞を観察 するための妨げとなる凝集形成を防ぐために非常に大切である。 ※1x Fixation Buffer – Fixation Buffer 10x を 10 倍の滅菌水で希釈する。1x Fixation Buffer の調整後、-20℃で保存する。24well plates で 10tests では 3mL(0.3mL × 10well)調整する。 ※1-PBS – PBS 10x を 10 倍の滅菌水で希釈する。調整後、1x PBS は 2-8℃で保存 する。24well plates で 10tests では 15mL 調整する。 ※Staining Mixture – (Prepare just prior to use) 3mL/10well Staining Solution の調整に以下の試薬を用いる。 ・300µL Staining Solution 10x ・37.5μL Reagent B ・37.5μL Reagent C ・75µL X-gal Solution ・2.55mL 滅菌水 溶液中に凝集が残らないように Staining Solution を 0.2μm filter を用いて濾過す る。 Procedure 1. 細胞から培地を吸引する。 2. 0.3mL 1x PBS で 2 回洗浄する(per well/plate)。細胞がはがれないように丁寧に 洗浄溶液を吸引する。 3. 0.3mL/well 1x Fixation Buffer を加え室温で 6-7 分インキュベートする。 4. 固定している間に上記の Staining Mixture を調整する。 5. 0.3mL 1x PBS で 3 回洗浄する(per well/plate)。 6. 0.3mL/well Staining Mixture を加える。 7. 細胞が青色に染色されるまで 37℃でインキュベートする(w/o CO2, 2hours to overnight)。 77 三重大学大学院 工学研究科 8. 乾かないように plate を Parafilm で密閉する。 ※老化細胞の染色は pH に依存している。したがって、細胞は染色している間は CO2 が豊富な状態でインキュベートしてはいけない。 9. 顕微鏡で細胞を観察する。染色された細胞数と総細胞数をカウントする。 β-galactosidase 発現細胞の割合を求める。 10. 染色後、Staining Solution を除き 1x PBS と入れ替えてもよい。 Appendix 1 Relative Volumes for Scale Up/Down of Staining Procedure Plate Well diameter (mm) Growth area (cm2) Volumes relative to 35 mm plate 100 mm 100.00 78.50 8.26x 60 mm 60.00 30.00 3.15x 35 mm 35.00 9.50 1x 6 well 34.80 9.50 1x 12 well 22.10 3.80 0.4x 24 well 15.60 1.90 0.3x 96 well 6.40 0.32 0.034x 78 三重大学大学院 工学研究科 A-2. DCF 感受性-細胞内 ROS の測定法 [原理] 活性酸素種(ROS)の生体内での役割を解明するために、ESR 法、吸光法、蛍光 法、化学発光法など種久の検出法が開発されてきた。その中でも蛍光プローブをロ ードした生細胞を蛍光顕微鏡下観測する方法は、生きている状態での生物応答を 感度よく捉えることができ、近年汎用されている。ROS の蛍光プローブとして、2’,7’ジクロロジヒドロフルオロセイン(DCFH)やジヒドロローダミン 123(Dihydrorhodamine-123)などがある。これらは分子内にベンゼン環を複数持つ。 しかし、その共役系の広がりは無く、可視領域に吸収・蛍光を持たない。また、ほぼ 全ての ROS と反応して蛍光を発するため、ROS 蛍光プローブとして頻繁に用いら れている。本研究では蛍光プローブとして 2’,7’-Dichlorodihydrofluorescein diacetate(DCFH-DA)を用いて測定を行った。 DCFH-DA は細胞膜を通過し細胞内に存在するエステラーゼによって DCFH へ と加水分解される。DCFH-DA 自体は酸化作用によって蛍光を発することはほとん ど無いと考えられている。加水分解された DCFH は ROS と速やかに反応して蛍光 物質である DCF を生成する(励起波長 502 nm、蛍光波長 520 nm)(Fig.10-1)。 [試薬・器具・機器] ・ ・ ・ ・ ・ 2’,7’-Dichlorodihydrofluorescein diacetate(DCFH-DA) (D-6883/SIGMA) dimethyl sulfoxide(DMSO) (049-07213/Wako) Fluoview FV1000(共焦点レーザー顕微鏡) (OLYMPUS) FV10-ASW(測定ソフト) (OLYMPUS) Image J(輝度解析ソフト) 79 三重大学大学院 工学研究科 COOH H Cl H3CCOO O Cl OCOCH3 DCFH-DA(非蛍光物質) 細胞膜 細胞内 esterase hydrolysis COOH H Cl HO COOH Cl O OH Cl ROS oxidation Cl HO DCFH(非蛍光物質) O DCF(蛍光物質) 蛍光波長 520 nm 共焦点レーザー顕微鏡による観察 輝度解析 ROS 測定 Fig.10-1 O 蛍光プローブ DCFH-DA の反応機構の概念 80 三重大学大学院 工学研究科 励起波長 502 nm [操作準備] DCFH-DA の調整 ① DCFH-DA の保存方法:窒素ガスで置換した容器に DCFH-DA(粉末)の 入ったサンプル瓶を入れ、密封した。シリカゲルを用いて、-20℃で乾燥 保存した。 ② Stock solution 調製:DCFH-DA(粉末)4 mg を無水の DMSO 826 μl に溶解 し、10 mM DCFH-DA を調製した。0.5 ml アシストチューブに 20 μl ずつ分 注した。 ③ Stock solution 保存:分注した DCFH-DA は 50 ml 遠沈管に入れ、窒素ガ スで空気を置換し、密封した。シリカゲルを用いて、-20℃で乾燥保存し た。(溶媒が水分を吸収しやすく色素の分解を起こすため、無水状態にし て乾燥保存しなければならない) ④ DMSO の蒸留:減圧蒸留にて精製し、無水状態にした。保存は試薬ビン に移し、ビンの中の空気を窒素ガスで置換して、密封した。デシケーター を用いて、室温で乾燥保存した。 ⑤ 100 μM DCFH-DA 調製:使用直前に Stock solution を培地で 100 倍希釈 し、0.22 μm フィルター滅菌を行った。 H2O2 水溶液の調整 100mM H2O2 水溶液の作製 113µL の 30% H2O2 を 9.887mL の滅菌水に入れ、100mM H2O2 水溶液を作製した。 1mM H2O2 水溶液の作製 1.133mL の 30% H2O2 を 8.867mL の滅菌水に入れ、1M H2O2 水 溶液を作製し、その 1M H2O2 水溶液から 10µL を滅菌水 10mL に いれて 1mM H2O2 を作製した。 H2O2 + 10µM DCFH 溶液の作製 ① 凍結してある 10mM DCFH 溶液 20µL を M199 培地 20mL に入れて 10µM DCFH 混合培地を作製する。(これが、Control 用の培地とな る。) ② 上記の 10µM DCFH 混合培地を 1.08mL 取り、そこに 1mM H2O2 を 0.12mL 加える。(0.1mM H2O2 + 10µM DCFH 混合培地) 81 三重大学大学院 工学研究科 [操作] Ⅰ 24well plate への播種 ① 24well plate に細胞培養用セルディスクを置いた。 ② 10%FBS/培地を 0.4mL/well でプレインキュベートした。 ③ 細胞懸濁液(播種密度 1×104 cells/cm2)を播種した。 (この時に 1Sample につき、Control 用に 24well plates を 1well、0.1mM H2O2 用に 2well 用意する。) ④ 37℃、5%CO2 インキュベーター内で confluent まで培養した。 (AAG, TMG 添加時には 1 週間培養した。) Ⅱ 試験 ① 培地を吸引し、PBS で洗浄した。 ② 終濃度 0.1mM の H2O2 と終濃度 10μM の DCFH-DA を同時に曝露し、軽 くピペッティングして暗所・室温条件下で 15 分間静地した。 (Control の 1well に DCFH のみの混合培地を、0.1mM H2O2 用の 2well に 0.1mM H2O2 + 10µM DCFH 混合培地を加える。) ③ 曝露終了後、共焦点レーザー顕微鏡にて DCF 蛍光を観察した。 <AAG, TMG 添加培地の作製> 1mM AAG 水溶液の作製 AAG 0.0135g を 40mL の滅菌水に溶解し、1mM AAG 水溶液を作製する。 1mM TMG 水溶液の作製 TMG 0.0159g を 40mL の滅菌水に溶解し、1mM TMG 水溶液を作製する。 <AAG 添加培地> 1. 1mM AAG 水溶液を 3.70µL を 10% FBS/M199 5mL に加え、250µM AAG/ 10%FBS/M199 培地を作製した。 2. 250µM AAG 培地を 10 倍希釈、100 倍希釈することで、25µM、2.5µM AAG 培地を作製した。 <TMG 添加培地> 1mM TMG 水溶液を 1.26µL を 10% FBS/M199 5mL に加え、500µM TMG/ 10%FBS/M199 培地を作製した。 2. 500µM TMG 培地を 10 倍希釈、100 倍希釈することで、50µM、5µM AAG 培地を作製した。 1. 82 三重大学大学院 工学研究科 Ⅲ 共焦点レーザー顕微鏡による蛍光の測定 ① 電源を入れ、顕微鏡の条件設定を行った。 ② 顕微鏡の台にシャーレを置き、透過観察(目視)で焦点を合わせた。 ③ シャーレに励起光を照射し、スキャンしてコンピュータの画面を見ながら焦 点を合わせた。蛍光が最も強く映る焦点で撮影した。 ④ シャーレを移動させていき、ランダムで計 4 ヶ所画像を撮影した。 共焦点レーザー顕微鏡による蛍光の測定は以下の設定で行った。 蛍光フィルター NIBA Dyelist Alexa Fluor 488 検出器の感度調節(HV) 650 HV Gain 1x Offset 0% レーザー出力の調整(Laser) 20% コンフォーカルアパチャー(C.A) 80um ハロゲンランプ調光(Lamp) 2.9 V Filter Mode Kalman Line 2 スキャン速度 2.0 us / Pixel 画像サイズ(size) 1:1 対物レンズ、Zoom 512by x 10、x2 Ⅳ データ解析 輝度解析は画像解析ソフト Image J を用いて数値化した。手順は以下の通り。 ① Image J を開き、輝度解析する画像を読み込んだ。(倍率は 200 倍の画像 を選択した。) ② ツールバーの Image から 8 bit monocro を選択し、画像をグレースケール にした。 ③ ツールバーの Process から substract background を選択し、100pixels に合 わせ、画像のバックグラウンドを調節した。(この操作によりバックグラウンド の pixel が 0 もしくは 1 になっていることを確認した。) 83 三重大学大学院 工学研究科 ④ ツールバーの Image → Adjust → Threshold を選択し、細胞の輝度を手動 で調節した。(この時に細胞がある程度区別できるように、かつバックグラウ ンドとの区別もできるように輝度を調節する。また、apply を押さないように する。) ⑤ ツールバーの Analyze → Set measurement から Mean Grey Value にチェッ クを入れる。(この時に他にもチェックが入っていても良いが、必要なものは Mean Grey Value のみである。) (一度、Set measurement でセットしたら以後この作業は行わなくても良い。) ⑥ ツール―バーの Analyze から Analyze particle を選択し、Size、Circulatory、 shows を変更し、Display、Exclude on Edge、Clear にチェックを入れる。(以 下参照) Size: 50-infinity (pixel のサイズの調整。基本はこの数値で良い。) Circulatory: 0-1.0 (変更なしでよい。) show: outlines (輝度解析を行った後にアウトラインを表示する。) Display (on), Exclude on Edges (on), Clear (on) then OK ⑦ 表示された数値をエクセルファイルにコピーし、画像4枚の平均値を算出 し、それを蛍光強度とした。 84 三重大学大学院 工学研究科 A-4.免疫化学染色 [原理] 標的分子を非常的に認識する抗体の性質を利用して、細胞の中のタンパク質 の局在を可視化する方法。観察したい標的分子に対する抗体(一次抗体)を加え、 その次に一次抗体を認識する抗体(二次抗体)を加える。そして、二次抗体に付加 されている蛍光を観察することで、標的分子の局在を知ることができる。一連の反 応は全て適度な塩濃度を持った緩衝液中で行い、乾燥させないのが基本である。 それぞれの蛍光物質に対応する波長の励起光当て、蛍光を検出する(Fig.10-2)。 抗原タンパク質 二次抗体 FITC 標識 一次抗体 Fig.10-2 抗原抗体反応を用いた免疫化学染色 ・FITC(fluorescein isothiocyanate) 緑色系の蛍光色素で、この色素は安定で、抗体活性を阻害せず、抗体への標 識が容易で安定、蛍光効率が高い、最大吸収波長と最大発光波長がかなり離れて いるなどの標識用蛍光色素の要件をかなり満たしている。 HO O O COONa N C S Fig.10-3 FITC 85 三重大学大学院 工学研究科 [試薬・器具・機器] ・ 秤 ・ ・ ・ ・ ・ ・ ・ ・ Vortex ピペット ピペッター マイクロピペット 遠沈管 遠沈管立て アルミホイル 共焦点顕微鏡(FV1000, Olympus, Tokyo, Japan) ・ アルブミン ・ ・ ・ ・ aceton (WAKO) methanol(WAKO) PBS(SIGMA) Goat anti-mouse IgG(H+L) FITC conjugate (Cat. No. AP308F / Millipore) ・ Propidium iodide(PI) (P4170-25MG/SIGMA) ・ Anti-Cytokeratin 18 Mouse-Mono(RGE53) ・ (Cat.No. MUB0327S / フナコシ) ・ Anti-Cytokeratin 18 phospho Ser 52, Human Rabbit (Cat.No. SC-17032-R /コスモバイオ) ・ mouse anti-human smooth muscle actin (Cat.No. M085101 / DAKO) [前準備] ① 秤でアルブミンを 4g 量り取った後、50ml 遠沈管に移し、PBS をピペットで 40ml 入れ、Vortex にて遠心した。 ② 作成した 1%BSA/PBS は冷蔵庫にて保存した。 [操作] ① 細胞がいる φ35 シャーレの培地を取り除き、PBS 洗浄を行った。 ② Aceton/methanol(1:1)をサンプルに加えて、r.t で 5 分間静置し固定した後、 その固定液を取り除き 10 分間風乾した。 ③ 1%BSA/PBS をサンプルに加えて 20 分静置した。 ④ サンプルに一次抗体(希釈率;抗体:1%BSA/PBS=1:200)を 1ml 加え、4℃ (冷蔵庫)、飽和湿度で overnight (10 時間以上)させた。 86 三重大学大学院 工学研究科 ⑤ 一次抗体を取り除き、1%BSA/PBS で 3 回洗浄した。 ⑥ サンプルに二次抗体(希釈率;抗体:1%BSA/PBS=1:200)を 1ml 加えて、ア ルミホイルで包み、30 分間、暗所、r.t で静置した。 ⑦ 二次抗体を取り除き、1%BSA/PBS で 3 回洗浄した。 ⑧ 共焦点レーザー顕微鏡で観察した。 [共焦点レーザー顕微鏡操作方法] Ⅰ システムの立ち上げ ① パソコンを ON にした。 ② レーザーを ON にした。 ③ ④ モニター上にパスワード入力画面が表示された後、水銀ランプを ON にし た。 ユーザー名・パスワードを入力し WindowsXP へログオン。 User ID: Administrator Password: fluoview ⑤ をダブルクリックしユーザー名・パスワードを入力し、 FV10-ASW ソフトウェアを起動した。 User ID: Administrator Password: Administrator 87 三重大学大学院 工学研究科 Ⅱ 蛍光試薬選択 ① DyeList ボタンをクリックし、All Clear ボタンをクリックしリセットした。 ② DyeList パネルから観察する蛍光試薬を 選びダブルクリックした。 ③ ④ Apply ボタンをクリックして閉じる。 CHS1 の蛍光試薬が変更したことを確認した。 88 三重大学大学院 工学研究科 Ⅱ 顕微鏡で目視観察 ① ハンドスイッチで対物レンズを選択した。 (10,20 倍レンズ:ドライ 40,60 倍レンズ:オイルを用いた。) ② パソコン上のアイコンをクリックし、ハロゲンランプ、蛍光レーザーの ON、 OFF をした。 OFF ② ハロゲンランプ ON 蛍光レーザーON 顕微鏡手前のフォーカススイッチ等によりピント調節した。 Ⅲ 画像の取得(試し撮り) ① HV の値を 600~680、スキャン速度 8.0us/Pixel、画素数 512by にセットし た。 微分干渉像 TD1 の値は HV100 前後にする。 (微分干渉像が不必要の場合はチェックをはずす。) 89 三重大学大学院 工学研究科 ② をクリックし、画面を見ながらピントを合わせ微調整した。 Ⅳ 画像の取得(本番) ① 40.0us/Pixel に設定を変更した。 90 三重大学大学院 工学研究科 ② ③ をクリックし、画像を取得した。 取得した画像の上で、右クリックし Export を選択、名前をつけて保存し た。 91 三重大学大学院 工学研究科 Ⅴ システムの終了 ① FV10-ASW ソフトウェアを終了した。 ② WindowsXP を終了した(Start/ShutDown→「ShutDown」を選択)。 ③ レーザーを OFF にした。 ④ 水銀ランプを OFF にした。 補足 ・向き・角度の調整 試料を動かさずに撮影可能 ・デジタルズーム 対物レンズを換えずに高倍率で観察可能 通常、Offset を 0 にしておく。 HV だけ値を変える。 単染色ではチェックを入れない。 92 三重大学大学院 工学研究科 A-5. 二次元電気泳動 ○目的 細胞や組織に存在するタンパク質を電解の電気泳動により二次元的に分離する ことで、通常の分子量で分離する SDS-PAGE より多くのタンパク質の変化・定量を 行う。 ○操作の流れ 1 日目 2 日目 3 日目 溶液の調整 & ポリアクリルアミドゲルの作製 & ゲルストリップの膨潤 ↓ タンパク抽出 ↓ 等電点電気泳動 ↓ 等電点電気泳動後のゲルストリップの SDS 処理 及びアルキル化処理 ↓ SDS-電気泳動 ↓ 固定 ↓ 染色 ↓ スポットの検出 93 三重大学大学院 工学研究科 ○測定の原理 細胞や組織に存在するタンパク質を二段階の電気泳動により二次元的に分離す る手法である。一次元目は等電点電気泳動によりタンパク質を分離し、二次元目は SDS-PAGE により分子量で分離する。 pH 7 4 250kDa 25kDa A-5-1. 溶液の調整およびゲルの作成 ○溶液調整 基本的に使用する溶液は用事調整 <使用器具・試薬> Urea Thiourea CHAPS Dithiothreitol(DTT) Pharmalyte(pH 3-10) Protease Inhibitor (219-00175/Wako) (208-01205/Wako) (347-04723/Wako) (045-08974/Wako) (17-0456-01/GE) Triton X-100 Acetic acid (T9284/Sigma) (017-00256/Wako) Bromophenol Blue (BPB) Tris HCl (M8G8844/半井化学薬品株式会社) (207-06275/Wako) (080-01066/Wako) 94 三重大学大学院 工学研究科 SDS Glycerol Iodoacetamide Glycine Methanol (199-07141/Wako) (17018-25/Nacalai) (095-02891/Wako) (077-00735/Wako) (137-01823/Wako) Flamingo (x10) 溶液 Milli-Q (161-0491/Bio-Rad) <タンパク抽出液> Urea Thiourea 20%(w/v)CHAPS (0.10g) Dithiothreitol(DTT) 1.50g 0.75g 0.50mL 0.05g Pharmalyte(pH 3-10; 使用ゲルの pH に合わせる) Protease Inhibitor 以上を Milli-Q で 5mL にメスアップする。 0.10mL 適量 *タンパク抽出液は DTT を入れずに 1mL ずつに分注し、冷凍庫で保存可能。 *DTT は強力な還元剤であるため、使用直前に入れる。 * Pharmalyte はゲルの pH レンジをカバーしているものを選択すること。 <一次元目ゲル膨潤液 (ゲルストリップ 4 本分) > Urea Thiourea 20%(w/v)Triton X-100 Dithiothreitol (DTT) 7.2g 3.04g 2mL 0.04g Pharmalyte (pH 3-10; 使用ゲルの pH に合わせる) 0.1M acetic acid 0.20mL 0.50g 0.1%(w/v) BPB 0.50mL 以上を Milli-Q で 20mL にメスアップする。 *DTT は使用直前に入れる。 *BPB は着色するためであり、上記の通りの用量でなくても良い。 95 三重大学大学院 工学研究科 *20%(w/v)Triton X-100 は作り置き可能(約 1 年) *0.1M acetic acid は作り置き可能(約 1 年) * Pharmalyte はゲルの pH レンジをカバーしているものを選択すること。 <SDS 処理化液 (ゲルストリップ 2 本分) > Urea Dithiothreitol (DTT) 0.5M Tris-HCl, pH 6.8 10% (w/v) SDS 3.63g 0.05g 0.5mL 2.00mL 0.25mL 5.00mL 0.1%(w/v) BPB 50%(v/v) Glycerol *DTT は使用直前に入れる。 *BPB は着色するためであり、上記の通りの用量でなくても良い。 *0.5M Tris-HCl, pH 6.8 は作り置き可能(約 1 年) *10% (w/v) SDS は室温で保存可能 *50%(v/v) Glycerol は作り置き可能(約 1 年) <アルキル化処理液 (ゲルストリップ 2 本分) > Urea Iodoacetamide 0.5M Tris-HCl, pH 6.8 10%(w/v) SDS 0.1%(w/v) BPB 50%(w/v) Glycerol *BPB は着色するためであり、上記の通りの用量でなくても良い。 96 三重大学大学院 工学研究科 3.63g 0.45g 0.50mL 2.00mL 0.25mL 5.00mL <SDS-泳動バッファー (Tris-Glycine 系) > 10x バッファー Tris 30.3g Glycine 144g SDS 10g Distilled Water to 1000mL 1x バッファー Tris Glycine 3.03g 14.4g SDS Distilled Water 1.0g to 1000mL *二次元目の電気泳動では約 1.8L 使用するため 1 日目に作製するとよい。 *10x バッファーの場合はストックしておき、使用前に 10 倍希釈して用いる。 *このバッファーは陰極側も陽極側も同じバッファーで良い。 <タンパク固定液 (500mL / 二次元目ゲル 2 枚分) > メタノール 250mL (終濃度 50%) 酢酸 Milli-Q 50mL (終濃度 10%) 200mL *使用後はシンクには捨てずに 5 研のポリタンクへ捨てる。 *タンパク固定液は二次元目の電気泳動終了 30 分ほど前に作製する。 *タンパク固定液は SDS-電気泳動中に作製するとよい。 <染色液 (400mL / 二次元目ゲル 2 枚分) > Flamingo (x10) 溶液 Milli-Q 40mL 360mL *染色液は 1x の溶液を作製しておき、4℃で保存しておく。 *染色液は 5 回ほどリユース可能。 *SYPRO Ruby でも染色可能。ここでは Flamingo のみの組成を記す。 97 三重大学大学院 工学研究科 ○ゲルの作成 ゲルメーカーにて作製する場合、4 枚作製する場合は 240mL、2 枚作製する場合は 160mL 調整する。 ゲルメーカーを使用しない場合は、1 組あたり 40mL 調整する。 *ゲルメーカーを使用して 1 枚作成する場合は 80mL 調整する必要がある。 10% アクリルアミド溶液 ゲル枚数 1枚 2枚 4枚 ゲルメーカーの使用 無 有 有 全体量 40mL 160mL 240mL 30% Acrylamide, 0.8%Bis 13.3mL 53.3mL 80mL 1.5M Tris-HCI pH8.8 10mL 40mL 60mL Water 16.1mL 64.2mL 96.3mL 10% SDS 0.4mL 1.6mL 2.4mL 10% APS 175µL 0.7mL 1.1mL TEMED(直前) 30µL 120µL 180µL ※約 1 時間程度脱気させる(TEMED を加える前)。 *ゲル濃度は 10%~12.5%の範囲で作製する。(これ以外の濃度ではゲルが破損し やすいため) *TEMED は開始剤のため、流し込む直前に入れる。 *1.5M Tris-HCl pH 6.8 は 4℃で保存可能。 *10% SDS は室温で保存可能。 *10%APS は用事調整が好ましいが、4℃で保存可能。(約 1 週間) *ゲルは 30 分で固まるが、一晩室温にて重合させた方が綺麗なスポットが得られ る。 *ゲルの保存はジップロックに Milli-Q を入れ湿潤状態を保っていれば、4℃で 1 週 間保存可能。 98 三重大学大学院 工学研究科 ○泳動用プレートの組み立て方法 <使用器具・試薬> SDS-PAGE 用ゲルメーカー セパレーター ダミーアクリルプレート アンダープレート ポリエステル粘着テープ サージカルテープ SDS ゲル作製コーム (3037-00/anatech) (3037-00/anatech) (3022-07/anatech) (3037-00/anatech) (3070-41/anatech) (3070-38/anatech) (3068-40/anatech) (3068-34/anatech) (3068-35/anatech) 泳動用プレート(プレーン) 泳動用プレート(ノッチ、スペーサー付き) <操作> ① 泳動用プレートを 99%エタノールで拭き、乾拭きしてプレートを綺麗にする。 ② スペーサーが内側に来るように泳動用プレートを合わせる。 ③ 側面の片側をクリップなどで留め、ズ レないように固定し、台の上に寝かせ て置く。 ④ 泳動用プレートの両端(矢印の部分) にポリエステル粘着テープをあて、そ の後シワの無いように貼り付ける。 ⑤ 泳動用プレートの端に合わせてポリ エステル粘着テープを切断する。 ⑥ ポリエステル粘着テープを角の所で しっかりと折り目をつける。 99 三重大学大学院 工学研究科 ⑦ 泳動用プレートの側面にテープを 当て、真ん中から外側に向けて順 に貼っていく。(この時、空気が入ら ないように貼る。) ⑧ 同じように角にしっかりと折り目を つけて、同様に貼り付ける。 ⑨ 同様にもう片方の側面にもポリエステル粘着テープを貼る。 ⑩ ゲルメーカーに泳動用プレートをセットする。 この時に、泳動プレートがゲルメーカー本体の高さと、同一もしくは 0.5mm 程度 高いことを確認する。もし、低い場合にはセパレーターをもう一枚追加する。 ⑪ 先述のアクリルアミド溶液に開始剤の TEMED を入れ、少し混ぜたのちにゲル メーカーにアクリルアミド溶液を流し込む。 *アクリルアミド溶液は TEMED 以外をいれて、脱気させておく。(ゲル中に気泡 が入るのを防ぐため。) *ガラス板の間にはスペーサーを挟むことを忘れない。(忘れるとガラス板同士 がくっつき、剥がれない。) *ゲルは 30 分で固まるが、一晩室温で重合させた方が綺麗なスポットが得られ る。 <補足> 12.5%アクリルアミド溶液作製の場合 ゲル枚数 1枚 2枚 4枚 ゲルメーカーの使用 無 有 有 全体量 40mL 160mL 240mL 30% Acrylamide, 0.8%Bis 16.7mL 66.7mL 100mL 1.5M Tris-HCI pH8.8 10mL 40mL 60mL Water 12.5mL 50.0mL 74.9mL 10% SDS 0.4mL 1.6mL 2.4mL 10% APS 175µL 0.7mL 1.1mL TEMED(直前) 30µL 120µL 180µL ※約 1 時間程度脱気させる(TEMED を加える前)。 100 三重大学大学院 工学研究科 A-5-2 ゲルストリップの膨潤 <使用器具・試薬> 膨潤液 Immobiline DryStrip pH4-7NL, 18cm (17-1233-01/GE) (3600-14/anatech) (3600-14/anatech) (3650-01/anatech) ピンセット ゲルストリップ膨潤器 シリコン栓 クールホレスターIPG-IEF Type-PX <操作> ① グルストリップ膨潤器の片側にシリコン栓をし、膨潤液を 1 本につき約 5mL 入れ る。 ② ゲルストリップの保護シートをゆっくり剥がし、ゲル面を上にしてゲルストリップ膨 潤器に入れ、シリコン栓で封をする。この時にゲル面に傷をつけないように注 意する。傷をつけると電気泳動パターンの乱れになる。 膨潤器 保持板 ゲル面を上にする 乾燥したゲル 保護シート 剥がす ゲルストリップ ③ クールホレスターIPG-IEF Type-PX のプレートの上にクールシートを敷き、ゲル ストリップの入ったゲルストリップ膨潤器を置く。ゲルストリップが膨潤液に完全 に浸かっている事を確認し、ゲルストリップ膨潤器が転がらないように注意す る。 *クールホレスターIPG-IEF Type-PX で電気泳動を行っている場合は、インキュ ベーター内などを使用して 20℃の条件下で膨潤させる。 ④ クールホレスターIPG-IEF Type-PX の電源を入れる。 ⑤ 温度入力キーを使い、設定温度を 20℃に設定する。 101 三重大学大学院 工学研究科 *温度コントローラーの上部はプレートの現在温度を表し、下部は設定温度を 表す。プレートが設定温度になるまでには数分かかる。 *室温は設定値温度の±10℃の範囲になるように空調する。 ⑥ 設定温度を 20℃一定のままにし、ゲルストリップの膨潤が十分になるまで一晩 静置する。 *膨潤時間は最短で 8 時間、最長で 24 時間にする。 *膨潤したゲルストリップは保存ができないため、用事調整すること。 <補足> 濃度の薄い試料液を泳動する場合、またはアプライする試料の量を増やしたい 場合には、ゲルスウェリングチャンバー(購入が必要;商品番号:3070-00)を使用し て、膨潤と同時に試料を添加する方法が存在する。 ただし、プロテアーゼを含む試料などには試料塗布用ろ紙によるアプライ方法の方 が良い。また、SDS を含んだ抽出液で調整したサンプルでは以下の方法ではでき ない。 ① 膨潤液を調整する。 ② 試料を調整する。(試料調整方法は後述) ③ 調整した試料に膨潤液を加える。 *最終液量はゲルストリップの長さにより異なる。 ④ ⑤ ⑥ ⑦ 1cm の長さに対して約 19.4µL の液量で膨潤を行う。例えば、18cm の場合で は、19.4µL×18(cm)となり、約 349.2µL の溶液で膨潤させる。この液量のうち、 試料の割合を 1/6 から 1/2 にする。つまり、18cm のドライストリップを膨潤する場 合は、試料 58.2µL ~ 174.6µL に膨潤液を加えて最終液量 349.2µL になるよう にする。 膨潤液を加えた試料をゲルスウェリングチャンバーに入れる。 ゲルストリップの保護シートを剥がし、ゲル面を下にしてその上に置く。 ゲルストリップの両端からシリコンオイル 1.5mL ほどゆっくり注ぎ、空気から完全 に遮断する。 蓋をしてゲルスウェリングチャンバーをインキュベーターの中に置き(設定温度 20℃)、静置する。 ⑧ 設置値温度を 20℃一定のままにして、ゲルストリップの膨潤が十分になされる まで一晩静置する。膨潤時間は最短で 8 時間、最長で 24 時間にする。 *膨潤時に使用したシリコンオイルは再利用不可。 102 三重大学大学院 工学研究科 A-5-3 細胞からのタンパク抽出方法 <使用器具・試薬> アシストチューブ 超音波粉砕機 超速遠心機 Ice <操作> ① 空のアシストチューブの重量を測定する。 ② 培地を除いて、氷冷した PBS 1mL で 1 回容器内壁を洗浄する。 ③ 洗浄した PBS を捨て、新たに PBS を 1mL 入れた状態で、氷上でセルスクレー パーなどを用いて細胞を掻き集め、アシストチューブへ移す。 ④ 5000rpm、4℃、5 分間遠心する。 ⑤ 遠心後、出来るだけ完全に上澄みの PBS を除き、細胞の質重量を量る。(この 時点で一回限り凍結保存してもよい。) ⑥ 細胞の湿重量に対して 4 倍量のタンパク抽出液を加えて、氷冷下で超音波破 砕する。 ⑦ 15000rpm、4℃、20 分間遠心を行い、上清を採取し、これを試料とする。 <試料の調整の注意点> *試料を調整したら 1 時間以内に等電点電気泳動を行う方が良い。 *タンパク定量を行う場合は、等電点電気泳動を行った後に残った試料で定量を行 うと良い。 *試料によっては抽出物の状態で保存したものを使用すると、超低温条件下で保存 した場合でも再現性が得られない場合がある。保存するときは、組織、細胞など破 砕をする前の状態で凍結保存すると良い。 103 三重大学大学院 工学研究科 A-5-4 等電点電気泳動(一次元目) <使用器具・試薬> クールホレスターIPG-IEF Type-PX クールシート トレイ 電極 (2 個) ゲルストリップ保持版板 低粘度シリコンオイル 電極用ろ紙 (3650-01/anatech) (3650-08/anatech) (3650-03/anatech) (3650-04/anatech) (3650-10/anatech) (3600-11/anatech) (3600-12/anatech) 試料用ろ紙 試料ろ紙押え用アタッチメント 高電圧用セフティカバー付きコード (赤・黒) パワーホレスター Pro3900 Immobiline DryStrip pH4-7NL, 18cm (3600-13/anatech) (3650-18/anatech) (3202-05/anatech) (3900-01/anatech) (17-1233-01/GE) ゲルストリップ膨潤器 ピンセット (3600-14/anatech) <操作> ① クールホレスターIPG-IEF Type-PX の電源を入れ、設定値温度を 20℃に設定 する。 *温度コントローラーの上部はプレートの現在値温度を示し、下部は設定値温 度を示す。温度が設定温度になるまでには数分かかる。 ② クールホレスターIPG-IEF Type-PX のプレートの上にクールシートを敷き、トレイ を置く。トレイのつまみが赤色の方が左側に来るようにし、黒色が右側に来るよ うに置く。 ③ トレイに少量のシリコンオイル(大気と遮断目的)を入れ、ゲルストリップ保存板を セットする。 *この時、ゲルストリップ保存板とトレイ底面の間には空気を残さない。 104 三重大学大学院 工学研究科 ④ 膨潤済みのゲルストリップを膨潤器からピンセットで取り出し、平らなろ紙または キムタオルなどの上にゲル面が横を向くように弧を描くように立てる。この状態 で、必ず 60~90 秒静置し、余分な膨潤液を取り除く。 *ゲルと取り出す時にはゲル面が膨潤器に触れないように注意する。 *余分な水気があると電気泳動パターンの乱れの原因となる。 ゲルストリップ キムタオル ゲル 保持板 キムタオル 横から見た図 ⑤ ゲルストリップをゲルストリップ保持板の溝にゲル面が上向きになるように置く。 *ゲルストリップには向きがあるので、+と印字されている方が左側(陽極側)に 来るようにする。 *トレイにはドライストリップの長さに合わせた印があるので、目安にする。 *2 本の場合はゲルストリップ間を 1 本分空けておき、左ゲル端を揃えて置く。 ⑥ 電極用ろ紙を 2 枚用意し、Milli-Q をたっぷり均一に染み込ませた後、キムワイ プなどに電極用ろ紙を挟み、上から軽く押さえて Milli-Q を取り除く。キムワイプ 内の電極用ろ紙の位置を変えて、同じ作業を 4~5 回繰り返す。 *水気が多いと、電気泳動パターンの乱れの原因となる。 ⑦ 電極用ろ紙をゲルストリップのゲル部分の両端にセットする。 *電極用ろ紙はゲルが半分かかる状態でセットする。 *ゲルストリップが 2 本と少ないときは、電極用ろ紙を半分に切り使用することが 可能。 ⑧ 試料をパラフィルムの上に置いた試料塗布用ろ紙に染み込ませる。この時に全 ての試料が染み込むように 1 度試料塗布用ろ紙をひっくり返す。 105 三重大学大学院 工学研究科 試料塗布用ろ紙 1 枚あたり 18µL の試料を染み込ませることができる。 *アプライしたい液量が少量で試料塗布用ろ紙が乾きすぎている場合は、膨潤 液か抽出液を加えて、試料塗布用ろ紙 1 枚あたり 18µL になるようにする。 ⑨ ピンセットで右側(陰極側)の電極用ろ紙から 1mm ほど離したゲルストリップの上 に載せる。 *試料が 18µL を超える場合は試料塗布用ろ紙を同じ位置に最大 3 枚重ねて 使用することが可能。この場合は最大 54µL アプライできる。 *複数の試料をアプライした場合には、どのゲルストリップにアプライしたかが分 かるようにトレイの側面や装置の蓋などにラベルを張る。 電極用ろ紙 試料塗布用ろ紙 試料塗布用ろ紙 電極用ろ紙 ゲルストリップ 横から見た図 106 三重大学大学院 工学研究科 電極用ろ紙 ⑩ 電極を取り付ける。電極は両手で持ち、電極用ろ紙の真ん中に電極が来るよう にゆっくりトレイに取り付ける。電極を軽く押さえ、密着させる。 *上から電極を見て、中央に電極がセットされていることを確認する。 -極 +極 電極 電極 拡大 *電極をまっすぐにすること。トレイ に印字された線と電極下部につい 白金線 ている白金線の位置をそろえると、 大体電極用ろ紙の真ん中に来る。 印字された線 電極(陽極側) 電極(陰極側) ゲルストリップ 横から見た図 107 三重大学大学院 工学研究科 ⑪ 左の電極リード線を泳動槽本体の“+(赤)”差込口に、右の電極リード線を泳動 槽本体の“-(黒)”差込口にそれぞれ差し込む。 ⑫ 試料塗付用ろ紙が浮き上がるのを防ぐため、試料をアプライした側の電極に試 料塗布用ろ紙押え用アタッチメントを載せる。試料塗布用ろ紙押え用アタッチメ ントが試料塗布用ろ紙をしっかりと押えるようにするために、ピンセットで試料塗 布用ろ紙と接している部分を軽く押さえる。 ⑬ トレイにシリコンオイルを約 150mL ~ 200mL 流し込む。この時に側面から見て、 試料塗布用ろ紙、電極用ろ紙、ゲルストリップがシリコンオイルに浸かっている ことを確認。 *ゲルストリップの乾燥を防ぐため、また試料塗布用ろ紙、電極用ろ紙、ゲルスト リップを空気から遮断するため。これを怠ると、3500V の電圧がかかるためゲル が蒸発し、過電流が流れるので、危険である。 ⑭ 泳動装置の蓋を閉じ、パワーホレスター Pro3900 を高電圧用セフティカバー付 きコードで接続する。 *蓋が開いていると通電しない。 ⑮ パワーホレスター Pro3900 の電源を入れ、ゲルストリップに合ったプログラムを 確認する。 プログラムにない場合は、Menu → Opt → S-G → 18cm → 3-10 → 3500V → プログラムの保存先(1-9 まである)からプログラムを組む。プログラムは以下に記 す。 ⑯ パワーホレスター Pro3900 の Run ボタンを押して、等電点電気泳動を開始す る。 <プログラム> ステップ モード 設定電圧 設定電流 時間 1 2 3 4 V SG SV SV 500V 3500V 3500V 3500V 250mA 2mA 2mA 2mA 2:00M 6:00M 10:00M ∞ 定電圧で等電点電気泳動が行われた場合、合計 18 時間+ホールド時間 もしくは 108 三重大学大学院 工学研究科 ステップ モード 設定電圧 設定電流 時間 1 2 3 4 5 6 7 8 V SV SV SV SV SV SV SV 500V 700V 1000V 1500V 2000V 2500V 3000V 3500V 250mA 2mA 2mA 2mA 2mA 2mA 2mA 2mA 2:00M 1:00M 1:00M 1:00M 1:00M 1:00M 1:00M 1:00M 9 SV 3500V 2mA ∞ 定電圧で等電点電気泳動が行われた場合、合計 18 時間+ホールド時間 *モードの説明 V:定電圧モード。定電圧で泳動を行う場合に選択。 C:定電流モード。定電流で泳動を行う場合に選択。 W:定電力モード。電圧値、電流値、電力値の 3 つの値の上限を決定し、その上限 を越えないように泳動を行う場合に選択。 SV:セフティ定電圧モード。電流値のリミッター値を設定して、“定電圧”で泳動を行 う場合に選択。設定した電流のリミッター値に達して 5 秒が経過すると自動的 に Pause 状態になる。 SC:セフティ定電流モード。電圧値のリミッター値を設定して、“定電流”で泳動を行 う場合に選択。設定した電圧のリミッター値に達して 5 秒が経過すると自動的 に Pause 状態になる。 G:グラジェントモード。電圧値を直線的にあげて、もしくは下げて泳動を行うモード。 前のステップで設定した電圧値をスタート点とし、入力した時間内に入力した 電圧値まで上昇する。 SG:セフティグラジェントモード。電圧値を直線的にあげ、もしくは下げて電気泳動 を行う場合に選択。電圧値を変化させて電気泳動を行うが、何らかの理由で 電流値もしくは電力値が設定した値に達して 5 秒が経過すると、自動的に Pause 状態になる。 109 三重大学大学院 工学研究科 <注意> 等電点電気泳動を開始して、15 分ほど経過したら下記の 2 点を必ず確認すること。 ① 電流値の確認。 理想的な電流値は、0~0.2mA である。電流値が高いとサンプルに含まれる塩 濃度が高い可能性があり、15 分を経過しても 1mA を超える場合は電気泳動を 続けるとゲルが焦げる可能性がある。(不純物が多くても電流値は高い。) ② ゲルストリップに含まれる BPB が“+(陽極)側”に移動しているかを確認。 移動していない場合はセットに問題があり、電圧がゲルストリップに掛かってな い可能性が考えられる。この場合は、電源の出力を止めてから再度ゲルと電極 のセット部分をチェックすること。 *同じ試料をアプライしても色素(BPB)の移動の速度が異なることがあるが、これ は電気泳動に影響することはない。 <補足> ○シリコンオイルの再利用 一次元目の等電点電気泳動に使用したシリコンオイルは下記の手順で処理し、2 回目以降のシリコンオイルとして使用可能である。 1. 使用後のシリコンオイルは透明の容器に移す。 *シリカゲルをいれるため、透明の方がよい。 2. 移したシリコンオイルにシリカゲル(青いビーズ状が良い)を底から 1cm ほどの高 さまで入れて、一晩以上脱水を行う。 *一晩でなくても次回使用するまでこの状態で保存。 3. 次回使用する際にシリコンオイルをろ紙を使用して濾過し、ゲル片や埃などを 取り除く。 4. 等電点電気泳動終了後、シリコンオイルは再び、シリカゲル入りの容器へ移 す。 *次回の電気泳動に支障がなければ、繰り返し使用可能。繰り返し使用できる 目安は約 600mL 使いまわして、50 回ほど使用可能だが、使用状況により異な る。 *不純物が多く混入した場合には使用しない。 110 三重大学大学院 工学研究科 A-5-5 ゲルストリップの SDS 処理とアルキル化処理 <目的> SDS 処理は等電点電気泳動の次に行う SDS-ポリアクリルアミドゲル電気泳動のた めの前処理である。タンパク質を SDS 化し、分子量の違いで分離するのを助ける。 アルキル化処理はポリアクリルアミドゲル中に含まれるモノマーのアクリルアミドがタ ンパク質を修飾するのを防ぐ。質量分析やプロテアーゼシークエンサーによるアミノ 酸配列決定を行う場合はアルキル化を行う。 <使用器具・試薬> ゲルストリップ膨潤器 SDS 処理液 アルキル化処理液 ピンセット (3600-14/anatech) <操作> ① ゲルストリップの本数分の SDS 処理液、還元アルキル化処理液、Milli-Q のゲ ルストリップ膨潤器を準備する。 ② ③ ④ ⑤ *2 サンプルなら計 6 本必要。 SDS 処理液に DTT を加え、ゲルストリップ膨潤器に約 5mL ずつ入れる。 Milli-Q をゲルストリップ膨潤器に 9 分目まで入れる。 一次元目のプロ グラ ムが終了し ていることを 確認し て、パ ワーホレスタ ー Pro3900 の STOP を押して、停止後にパワーホレスター Pro3900 の電源を切り、 念のため接続ケーブルも外す。 *都合がつかない場合はホールド状態でしばらく放置。 電極をトレイから取り外し、ゲルストリップの上に載っている電極用ろ紙と試料塗 布用ろ紙をピンセットで取る。試料塗布用ろ紙がゲルストリップに張りついて剥 がれない場合は、付いたまま作業を続ける。SDS 処理を行うことで比較的剥が れやすくなるので、SDS 処理が終了してから剥がす。 ⑥ ピンセットでトレイからゲルストリップを取り出し、Milli-Q を 9 分目まで入れた膨 潤器のなかで 1 秒ほどシリコンオイルを洗い流す。 *トレイからゲルストリップを取り出す際には一度、トレイの淵にゲルストリップを 置き、しっかりつかんだ後に膨潤器で洗う。この時にゲルストリップをキムワイプ 等に落とし、ゲル面が付くと二次元目の電気泳動の乱れの原因となる。 111 三重大学大学院 工学研究科 ⑦ ろ紙などの上にゲル面が上になるように約 10 秒置き、余分な水気を取る。 ⑧ 用意しておいた SDS 処理液にゲル面が上になるようにゲルストリップを入れ、シ リコン栓をする。この時に、ゲル面を膨潤器に当てて、傷つけないようにする。 *サンプル情報を記したテープをゲルストリップ膨潤器に張り付ける。 ⑨ ゲル面が上になるように穏やかに 30 分間振とうさせる。 *止める際には、SDS 処理を 15 分行った後に凍結。解凍後は残りの 15 分から 再開。凍結させる際には、乾燥しないようにラップなどに包み、-80℃で凍結さ せる。約 1 ヶ月間凍結可能。 *アルキル化を行わない場合は SDS 処理を 40 分行う。 ⑩ SDS 処理の間に調整しておいたアルキル化処理液をゲルストリップ 1 本につき 約 5mL 膨潤器に入れる。 ⑪ SDS 処理が終わったらゲルストリップをアルキル化処理液にゲル面が上になる ように入れ、シリコン栓をする。 *この時にサンプル情報を記したテープをアルキル化処理のゲルストリップ膨潤 器に付け直す。 ⑫ ゲル面が上になるように穏やかに 15 分振とうさせる。 ⑬ ゲルストリップをピンセットで取り出し、SDS-電気泳動を行う。 112 三重大学大学院 工学研究科 A-5-6 SDS-電気泳動 <使用器具・試薬> 電気泳動槽(セフティカバー付き) ゲルストリップ押えシャークコーム 200 泳動用プレート(プレーン) 泳動用プレート(ノッチ、スペーサー付き) パワーホレスター Pro3900 高電圧用セフティカバー付きコード スパチュラ (3320-01/anatech) (3068-39/anatech) (3068-34/anatech) (3068-35/anatech) (3900-01/anatech) (3202-05/anatech) <前準備> ① 先述のポリアクリルアミドゲルを作製しておく。 ② SDS-電気泳動用の泳動バッファーを約 2L 作製しておく。 ③ 電気泳動槽は泳動バッファーがこぼれるのを防ぐため、トレイまたはバットの上 で行う。 <操作> 1. 作製しておいたアクリルアミドゲルのガラスプレートについているサージカルテ ープ(下部の白いテープ)を剥がす。 ポリエステル粘着テープ(黄色)は剥がさない。 *サージカルテープは、ゲルメーカーを使用せず、ゲルを 1 枚で作製した時に 必要なテープ。 2. 作製したアクリルアミドゲルを Milli-Q で洗浄する。 *この時にゲル片などが残っているとゲルストリップをうまく密着させて載せること ができないので、必ず取り除く。 3. 電気泳動槽にアクリルアミドゲルを差し込む。 この時に、泳動プレートのノッチ側(切り込みの入っているガラス板)が内側にく るようにセットする。 *泳動槽の下部には泳動用プレートを載せる部分があるので、そこに載るように セットする。 113 三重大学大学院 工学研究科 4. アルキル化処理が終了したゲルストリップの端をゲルストリップ膨潤器から出し、 ゲルストリップ保持板の余分な部分をはさみで切り取る。 *スラブゲルは 19cm であり、アクリルアミドゲルは 18cm であるため載せることが できない。 ゲル 切り取る ゲルストリップ 保持板 切り取る 5. アクリルアミドゲルの上にゲルストリップのゲル面が内側になるように載せる。(下 図参照。) ゲルストリップ ゲル面 保持板 ゲルストリップの保持板部分を 泳動用プレート(プレーン)に貼り 付けるようにして置く。 ゲルストリップを滑りやすくする ため、SDS-泳動バッファーもしく はゲルストリップの SDS 処理液 をアクリルアミドゲルの上にピペ ットを使って 0.5mL ほど流しこ む。 先の平らなスパチュラを使って、 ゲルストリップをアクリルアミドゲ スパチュラ ルに密着させる。ゲルストリップ の下に空気が入らないようにす る。 114 三重大学大学院 工学研究科 ゲルストリップの下に空気が入っ てしまった場合は、ゲルストリップ の保持板をスパチュラで何度か上 から押すことで、空気が浮き上が って抜ける。 6. ゲルストリップ押えシャークコ ームをゲルストリップの上に軽 く載せ、ゲルストリップが浮き 上がらないようにする。この時 にシャークコームが刺さらない ように注意する。ほんの少し刺 さった状態であれば大丈夫だが、数ミリ刺さった場合は場所を変え、置き直す。 7. 泳動用プレートを抑え込むために、泳動用プレート押え板を差し込んで固定す る。 8. 陽極側バッファー層に 1/3 ほど泳動バッファーを注ぐ。 9. 泳動用プレートをセットした陰極側バッファー層を中にいれる。アクリルアミドゲ ルの下部に気泡がある場合は陰極バッファー槽ごと軽く上下に動かして、気泡 を抜く。 10. 泳動バッファーを陽極側と陰極側の水位が同じ高さになるようにバッファーを満 たす。 *同じ高さにすると、水位が下がることがないので、泳動バッファーのリークを防 ぐことができる。 11. パワーホレスター Pro3900 と泳動槽を高電圧用セフティカバー付きコードでつ なぐ。 12. 定電圧で SDS-電気泳動を開始する。 始めは 20mA / 枚で設定し泳動を行う。 *この時、のちにシャークコームを取り除くことを忘れないように、あえて泳動槽 のセフティカバーはしない。 13. 15~30 分経過し、ゲルストリップ中の色素“BPB”がアクリルアミドゲルに完全に 移動していることを確認した後、パワーホレスター Pro3900 の Pause ボタンを押 して、一時停止させる。 14. 一時停止させたら、“ゲルストリップ押えシャークコーム”を取り除く。 115 三重大学大学院 工学研究科 15. パワーホレスター Pro3900 の電流値を 30mA にして SDS-電気泳動を再開す る。 サーキュレーターにて冷却しながら泳動を行う場合は定電流 40mA / 枚で泳動 が可能。 *泳動中はジュール熱が発生するため、電流値を高く設定しない。最高でも 45mA / 枚で行う。あまり高く電流値を設定すると泳動装置の破損の原因とな る。 *泳動時間は室温やゲル濃度により異なるが、3 時間から 5 時間程度。 16. 3 時間から 5 時間後、BPB の青い線が泳動用プレートの下から約 1cm のところ に移動したらパワーホレスター Pro3900 の Stop ボタンを押して電気泳動を終 了する。 *念のために接続コードを外す。 17. 泳動プレートを取り出す。 *泳動プレートは泳動バッファーで滑りやすくなっているので慎重に行う。また、 Milli-Q で洗浄すると滑りが緩和される。 18. ポリエステル粘着テープ(黄色)を剥がし、切り込みの入っている方の泳動用プ レート(ノッチ側)を下にして綺麗なキムタオルの上に置く。 19. スパチュラを使い、泳動プレートの間に差し込み、テコの原理を利用し、泳動プ レート(プレーン側:正方形のガラス板)を外す。 *この時にスパチュラを入れる 場所が端すぎると切れ込みの 入っているガラス板が割れる ので、必ず少し中で行う。 20. 塩基性、酸性が分かるようにアクリルアミドゲルの“+側:酸性側”の下を斜めに 切り落とす。 *切り落とすところは必ず酸性側の下にすること。 21. 一次元目のゲルストリップをアクリルアミドゲルから外す。 116 三重大学大学院 工学研究科 22. 泳動プレート(ノッチ側)にアクリルアミドゲルが張り付いているので、アクリルアミ ドゲルの左右の部分に丁寧に切り込みを入れる。 *切り込みを入れる際に裂 け目ができるとそこからゲ ルが避けてしまうので、丁 寧に扱う。 *押して切って進むという イメージでゲルの両端に 切れ込みを入れる。 23. 染色・脱色用タッパーに固定液を入れて、慎重にアクリルアミドゲルを移して、 染色作業へ移る。 *ゲルをタッパーに移す際に はゲル自身の重みでタッパ ーへ入れるようにする。 *写真のように少しだけゲル と泳動プレートに空気を入れ ると、ゲルは自然にタッパー に落ちていく。 *スパチュラの角でゲルを傷 つけないよう注意する。 117 三重大学大学院 工学研究科 <補足> ○分子量マーカーの使用 <前準備:アガロースゲルの作製> ① 0.2g のアガロースに 20mL の Milli-Q を 50mL ビーカーに入れてアガロースを 可溶化させる。 *正確に作製する必要はない。 ② 電子レンジで透明になるまで溶かして、室温まで冷めてから上部にサランラッ プ等をかけて輪ゴムで止め、4℃で保存する。(2 年間は保存可能) ふた付き容器でも良いが、ふたを付けたまま電子レンジをかけると容器が破損 するので、ビーカーを使用。 <分子量マーカーの作製・アプライ> ① パラフィルム上に試料塗布用ろ紙を半分に切って載せる。 ② 分子量マーカーを 9µL、ろ紙に塗布する。 ③ アガロースを溶かして、1000µL ピペットで吸い上げ、1 滴滴下する。 ④ アガロースが固まるまで静置する。 ⑤ ゲルストリップの両端のゲル部分を 3~5mm 切り落とす。 ⑥ ゲルストリップをスラブゲル上面にセット後、アガロースを塗布したろ紙を端にセ ットする。 ろ紙は、側面のスペーサーから 5mm 程離れた位置にセットする。(近過ぎると 側面に流れるので注意。) ⑦ シャークコームをセットし、電気泳動を開始する。 *アガロースを溶かす際には、吹きこぼれやすいのでこまめに電子レンジを止めて ビーカーを撹拌し、温める。 *1000µL ピペットで滴下後にチップに残っているアガロースはビーカーに戻す。 *分子量マーカーは、作り置きしない。 作製自体は 5 分程なので、SDS 処理の間で十分間に合う。 *作って時間を置き過ぎるとアガロースの膨らみが小さくなって、バッファー上面に 浮き易くなるので注意。 *分子量マーカーは、酸性側・塩基性側のどちら側にセットするかを決めて統一す る。 118 三重大学大学院 工学研究科 A-5-6 Flamingo による蛍光染色 <使用器具・試薬> Flamingo ゲルステイン タッパー Methanol (Invitrogen/161-0491) (WAKO/137-0183) 酢酸 Milli-Q <試薬の組成> 固定液 Methanol 酢酸 Milli-Q 250mL(最終濃度 50%) 50mL(最終濃度 10%) 200mL 染色液 Flamingo(×10)溶液 Milli-Q 40mL 360mL <操作> ① 固定液 250mL/ゲル 1 枚の割合で、タッパーに入れ 30 分振とうさせる。 ② Milli-Q250mL/ゲル 1 枚の割合で、3 回洗浄する。 ③ 10 倍希釈した染色液を、200mL/ゲル 1 枚の割合で、タッパーに入れ、1 時間振 とうさせる。(染色液が遮光性なため、タッパーはアルミホイルで十分に遮光す る。) ④ 染色液を遮光した容器に回収後、Milli-Q 250mL/ゲル 1 枚の割合で、1 回洗浄 する。 ⑤ ゲルの乾燥を防ぐ為、ゲルをクリアファイルに挟み、挟み口を濡らしたキムワイ プで包む。 ⑥ ジップロックの様なフリーザーバックに入れ、脱イオン水を適量入れて、乾燥し ないようにする。(ゲルが数枚ある場合は、各ゲルにサンプル名を記載したテー プを張り付ける。) ⑦ ゲルの露光を防ぐため、ゲルの入ったフリーザーパックをゲル運搬用の箱へ入 れる。 ⑧ 遺伝子実験施設の蛍光撮影機により、スポットの検出を行う。 119 三重大学大学院 工学研究科 A-5-7 画像解析 ○フルオロホレスター3000 Ver3.1 フルオロホレスター3000 Ver3.1 は蛍光染色された二次元電気泳動ゲルの画像 撮影を高感度で行い、その画像データから必要なスポットを選択し、切り出し作業 (手動作業)までを行う装置である。 <操作> ① フルオロホレスター3000 Ver3.1 の本体側面の電源を入れる。 ② パソコンのフルオロホレスター3000 のソフトウェア(FL3000 Ver3)を起動する。 *接続ステータスが、“未接続”の場合は、“接続”状態にする。 *ソフトウェアの上部メニューバーの“設定”から“環境設定”をクリックし、以下 のように設定する。 *設定した値は保存されるので、再度の設定は必要ない。 CCD カメラの温度設定:撮影には 10℃を推奨。 *室温が高い場合は室内を冷房にする。 撮影台からの距離 :ゲルサポートプレート(透明アクリル板 厚さ 2mm)の 上にゲルを乗せてスポットの切り出しをするために、 2mm に設定する。 ③ 使用目的に合わせたプレートに蛍光染色したスクラブゲルを乗せる。 ・画像解析用の画像を撮影する場合 ゲル撮影用プレート(黒色アクリル板)の上にスクラブゲルを乗せる。泡が 画像に写り込まないように、スラブゲルの下に挟まった泡を押し出す。 ・スラブゲルからの切り出しを行う場合 ゲルサポートプレート(透明アクリル板)の上にスクラブゲルを乗せる。泡 が画像に写り込まないように、スラブゲルの下に挟まった泡を押し出す。 *ゲルサポートプレートが反っている場合は新しい物を使用する。 ④ プレートの上に、マスクシート(黒色ロの字型シート)を被せる。 *マスクシートは光を反射しない均一にザラザラした方が表。マスクシートはプレ ートからの反射光を低減し、バックグラウンドを抑えられる。 ⑤ スラブゲルを乗せたプレート本体内部の撮影台の上に設置し、奥の左右にある ネジでマスクシート及びプレートを固定する。 ⑥ 本体内部の左右にあるランプユニットを回転させて、蛍光色素に対応するラン プ(LED)をスラブゲルへ向ける。 120 三重大学大学院 工学研究科 Blue と Green のランプ : SYPRO Ruby、Flamingo ゲルステイン、 Pro-Q Diamond、Pro-Q Emerald UV(375nm)のランプ : Phospho QUANTI *ランプの基盤ユニットを交換する場合は、本体の電源を切ってから交換作業を行 う。 ⑦ 蛍光色素に対応したフィルターをセットする。 SYPRO Ruby :ランプはフィルター無 ※550nm ショートパスフィルター付きでも撮影は可能 CCD カメラに 580nm ロングパスフィルター Flamingo ゲルステイン :ランプユニットに 550nm ショートパスフィルター ※ランプユニットにフィルターが無くても撮影は可能 CCD カメラに 580nm ロングパスフィルター Pro-Q Diaond :ランプユニットに 550nm ショートパスフィルター CCD カメラに 580nm ロングパスフィルター Pro-Q Emerald :ランプユニットに 490nm ショートパスフィルター CCD カメラに 520nm ロングパスフィルター Phospho QUANTI :ランプユニットはフィルター無 CCD カメラに 440nm ロングパスフィルター ⑧ 本体扉を閉めてパソコンのソフトウェアから操作する。 ⑨ “蛍光ランプ”エリアから蛍光色素に対応するランプをクリックする。 SYPRO Ruby、Pro-Q Emerald :Blue のランプ Flamingo ゲルステイン :Blue と Green(2 個)のランプ ※LED ユニットに 550nm のショートパスフィルターがない場合は、Blue のみ点灯 Pro-Q Diamond :Green(2 個)のランプ Phospho QUANTI :UV(375nm)のランプ ⑩ “撮影”エリアの“露光時間”に撮影秒数を入力し、“撮影”ボタンをクリックしてス ラブゲルを撮影する。撮影を止める場合は、“中止”をクリックする。 SYPRO Ruby 染色画像の取り込み時間の目安 :5~15 秒 Flamingo ゲルステイン染色画像の取り込み時間の目安 :3~10 秒 Pro-Q Diamond 染色画像の取り込み時間の目安 :60~120 秒 Pro-Q Emerald 染色画像の取り込み時間の目安 :120~240 秒 Phospho QUANTI 染色画像の取り込み時間の目安 :1~5 秒 *サンプル量、蛍光染色液のコンディションにより適切な露光時間は異なる。 121 三重大学大学院 工学研究科 *撮影した画像がサチュレーション(Saturation)を起こしているか確認する事がで きる。撮影したスラブゲル画像の右上にある“サチュレーション(Saturation)”をク リックすると、サチュレーションを起こしている位置が赤く表示される。 ⑪ 撮影した画像は、必要に応じて“画像調整”エリアにて編集する。 ⑫ 保存する画像形式・大きさ等に対応“保存”を選択してスラブゲル画像を保存 する。 *ProgenesisPG200 での画像解析には、“8bit TIFF 画像”を推奨。 全体画像の保存:上部メインメニューの“ファイル”からの保存方法 保存(○○○○ 撮影画像) :8bit TIFF または 16bit TIFF または(8bit)BMP フォーマット保存される。 *保存される画像には、白黒反転、強調処理などは反映されるがポイント の位置情報、画面の拡大縮小は反映されない。 保存(BMP 画像イメージ):BMP フォーマットで保存される。 *保存される画像には、白黒反転、強調処理、ポイント位置情報、画面の 拡大縮小までの反映された画像で保存される。 範囲指定の保存:スラブゲル画像の左上にある“動作モード”からの 保存方法 範囲保存 ○○○○ :8bit TIFF または 16bit TIFF または (8bit)BMP フォーマットで保存される。 ○Progenesis PG200/PG220 Progenesis は二次元電気泳動ゲル画像を比較して、ディファレンシャルなタンパ ク質スポットを判定する為の解析ソフトウェアである。 <設定手順> ① Progenesis PG200/PG220 を起動する。 ② Single stain analysis 実験を選択し、実験名 (日付でも良い)を入力し、Next をクリックす る。 122 三重大学大学院 工学研究科 ③ 画像を選択する。Add ボタンをクリックする とファイル選択画面が開き、必要な画像を 選択し、Next をクリックする。 ④ ゲル画像がプレビューされ、解析する範囲 を選択し、Next をクリックする。(2 枚目の画 像は Image プルダウンメニューから表示さ せることができる。) ⑤ 平均化画像を作成するウィザードが開か れるが、2 枚の画像比較の場合は何もせ ずに Next をクリックする。 ⑥ 解析プロトコルをロードするかどうかのアラ ートが表示されるが、ここではロードせず に No を選択した後、Next をクリックする。 ⑦ リファレンス画像を選択し、Next をクリック する。 123 三重大学大学院 工学研究科 ⑧ スポット検出にチェックを入れ、Next をクリッ クする。 ⑨ バックグランド差分の手法を選択するが、こ こではデフォルトで選択されている手法なら びにパラメーターをそのままにし、クリックす る。 ⑩ ワーピングとマッチングの確認を行うため、 いずれもチェックが入っていることを確認し、 Next をクリックする。 ⑪ ノーマライゼーションの手法を選択するが、 ここではデフォルトで選択されている手法な らびにパラメーターをそのままにし、Next を クリックする。 ⑫ 解析プロトコルの保存を確認するウィザード 画面が表示されるが、ここでは保存しない のでチェックを入れずに Next をクリックす る。 124 三重大学大学院 工学研究科 ⑬ 設定した実験に加え、必要ならば他の実 験も加えることができるが、ここでは設定し た実験のみ実施するので選択せずに Next をクリックする。 ⑭ ウィザードの最後の画面が表示され、Finish をクリックし、自動解析を実行する。 125 三重大学大学院 工学研究科 <画像解析> ここでは自動解析後の基本的な表示とスポット編集について取り上げる。詳細は 「Progenesis PG200/PG220 操作説明書」に記載。 内容 A)ソフトウェアインターフェイスの概要 B)スポット比較(ワーピングの確認) C)スポット編集(スポット数の確認) 操作 A) ソフトウェアインターフェイスの概要 解析ウィザードによる自動解析が終了すると解析が表示され、画像の左側には ナビゲーターがあり、実験ビュータブをクリックすると実験構成を確認できる。 実験ビューに表示されるアイコンを右 図に示す。緑色の四角の枠は現在表 示している画像を示している。 メニューツールバーにはスポット編集 ならびにスポット検出のためのツール が用意されている。またプログラムウイ ンドメニューのセレクトバーはいずれも それぞれ新しいウインドが開く。 イメージウインドにあるズームフィットボタン に画像全体が表示される。 をクリックすると、ウインドサイズ 126 三重大学大学院 工学研究科 B) スポット比較(ワーピングの確認) 1. メインツールバーのワープゲルボタンをクリックするとナ ビゲーターがワーピングモードに変わり、サブモードツー ルバーを確認することができる。 *メインツールバーのイメージドロップダウンリストから画 像表示を Gel 1 から Gel 2 に変更する。 2. 画像のイメージウインドツールバーにあるディスプレイオ プションボタンをクリックするとダイアログボックスが表示さ れ、現在表示されている項目にチェックが入っていること が分かる。 3. チェックを全て外し、イメージ表示をドロップダウンリスト の Normal から Overlaid に変更すると現在の画像(Gel 2) が緑色に、リファレンス画像(Gel 1)が紫色に表示される オーバーレイ表示になる。 *灰色、もしくは黒になったスポットワーピングが成功した スポット、緑や紫のままのスポットは画像間で違いのあっ たスポットである。 4. オーバーレイ表示およびワープ表示の色調を変更するには、イメージウインド ツールバーにあるコントラスト&カラーボタン をクリックして調整できる。 <手動によるワーピング最適化> 1. 解析ウィザードによる自動解析 を行わない場合はリファレンス が存在しないので、リファレンス 画像を作成する。Experiment タ グの Gel 3 を右クリックし、Create Reference を選択し、リファレン ス画像を作成する。 127 三重大学大学院 工学研究科 2. ワーピングボタン をクリックしワーピングモードに入る。 3. 表示画像は Gel 4 を選択した後、ナビゲーターの Main Image Display を Warped に変更し、Affect these gels はドロップダウン リストから Current gel を選択する。 4. サブモードツールバーから手動ワーピングボタンを選択する。 5. カーソルアイコンが緑色の矢印に変わり、ドラッグ&ドロップでランドマークを設 定できるようにする。 6. ズームツールを使用し、選択範囲を拡大表示する。 *緑色が現在のゲル画像で、紫色がリファレンス画像 7. 緑色のスポットをドラッグし、対象のスポットを少し移動させると、その他の緑色 のスポット全てが移動する。目的のリファレンスの位置でマウスボタンを離しドロ ップすると青い十字(ワープベクター)がランドマークとして表示される。 *Zoom to Fit ボタン で画像全体を表示することができる。 128 三重大学大学院 工学研究科 C) 1. 2. 3. スポット編集(スポット数の確認) 左上の Edit を選択し、Chose reference gel を選択する。 ツールバーの Create a new gel を選択し、Next をクリック。 Gel の名前にスポット数が表示される。 <補足> 本電気泳動装置(Anatech 製品)は 2012 年 6 月に納品されたものである。 本プロトコールは Anatech のプロトコールを基に本研究室用にアレンジしたもの である。 更にプロトコールの詳細を見るときや、変更点がある場合は Anatech のプロトコ ール(橙色のプロトコール 4 部)を参照のこと。 プロトコール 4 部 - クールホレスター IPG-IEF Type-PX - コンスタントパワーサプライ パワーホレスター Pro3900 - SDS-電気泳動装置 クールホレスター SDS-PAGE Dual-200K - SDS-PAGE 用ゲルメーカー 37/200、28/200、36/160 また、タンパク抽出や画像解析等で分からないことがある場合は Anatech 株式 会社の古賀正信に e-mail もしくは HP から(e-mail アドレスは以下)質問をすると よい。 Anatech 株式会社 営業部 古賀 正信 E-mail: [email protected] URL: http://www.anatech.co.jp Tel: 03-3812-8701 Fax: 03-3818-9167 〒113-0034 東京都文京区湯島 2-31-15 129 三重大学大学院 工学研究科 A-6. 統計処理 <操作手順> ① StatView-J 5.0 のファイル内にある StatView を起動する。 ② 新規データシート をクリックする。 ③ タイプを“実数”から“文字列”へ変更する。 ④ 下図の赤枠内にサンプル名(ex. #1, #2, #3)を明記し、右の列 2 にデータを 1 つずつ入れていく。 ⑤ “解析”ボタンをクリックし、新規ビューシートを選択する。 ⑥ 左のメニュー内の分散分析の“ ” → Post-hoc テストの“” → Tukey-Kramer の順にクリックする。 ⑦ 画面右に表示されている変数一覧の列 1 を独立、列 2 を従属と選択し、解 析の実行を選択する。 Tukey-Kramer: 列 2 効果: 列 1 有意水準: 5 % 平均値の差 #1, #2 72.667 #1, #3 -2.667 #2, #3 -75.333 棄却値 12.247 S 12.247 12.247 S S ⇒ 有意差有り 無印 ⇒有意差無し 130 三重大学大学院 工学研究科 B-1. 滅菌について <高圧蒸気滅菌> 高圧蒸気滅菌(オートクレーブ)は、滅菌したい器具を専用の滅菌缶や金属缶、ケ ースなどに入れ、滅菌テープで封印し、121℃/20 分にて行う。滅菌後は 50 度のオ ーブンに入れ、乾燥・保管する。 液体の高圧蒸気滅菌は専用の耐圧ビンに入れて行う。但し、液体は全体が均一 な温度(121℃)になるまで時間が掛かるため、通常の器具滅菌の場合よりも 1L あた り 20 分程余分に行う。 <乾熱滅菌> 乾熱滅菌も滅菌したい器具を専用の滅菌缶や金属缶に入れて行う。ピペットの場 合は吸入口に専用の綿を詰め、滅菌缶に入れて滅菌する。その他のガラス器具な どは口にアルミホイルで蓋をし、そのまま滅菌する。乾熱滅菌の温度と時間は以下 の通り(Table.B-2-1)。 一般的な滅菌 RNase free にするための滅菌 160~170℃/2~4h もしくは 180℃/8h 以上(Over Night) もしくは 180~200℃/0.5~1h 250℃/0.5h 以上 Table.B-2-1 乾熱滅菌 ※ 乾熱滅菌は冷めるまでが滅菌なので、必ず冷めるまでまつこと。 ※ 高圧蒸気滅菌と乾熱滅菌のいずれの場合も、必ず滅菌対象の材質・耐熱 温度を確認すること。機器の損傷の恐れもある。 <UV 殺菌> クリーンベンチは使用後に必ず UV 滅菌灯を点灯し、ベンチ内を殺菌した。 その際、ベンチ内のプラスチック製品は全てアルミホイルで巻くこと。 131 三重大学大学院 工学研究科 <主要器具の滅菌方法> ○クリーンベンチ内器具一式 ・ ピンセット×1 ・ 50ml、100ml ビーカー×各 1 ・ シャーレ×2 ① ブラッシングにより洗浄後、水洗いし、蒸留水で軽くリンスした。 ② 滅菌缶に器具を詰め、滅菌テープで封印し 121℃/20 分にて高圧蒸気滅菌を行 った。 ○手術器具一式 ・ ピンセット(拘つき)×1、(拘無し)×3~4 ・ ハサミ(直、先丸)×各 1 ・ 鉗子×1 ・ 滅菌糸(20cm 程度のもの)×20 専用の金属トレイに器具を詰め、滅菌テープで封印し、121℃/20 分にて高圧蒸気 滅菌を行った。 ○チップ、Reaction Tube with Cap(PCR 専用チューブ) 専用のケース、金属缶に詰め、滅菌テープで封印し、121℃/20 分にて高圧蒸気滅 菌を行った。詰める作業は必ず手袋を着用して行った。 ○10ml ピペット、パスツールピペット ①20 倍希釈の無リン洗剤に約 24 時間浸漬後、約 24 時間水洗いした(浸漬液 は 2 ヶ月毎に交換した)。 ②水気を取り、10ml ピペットは吸入口に綿栓をし、滅菌缶につめた。パスツー ルピペットは綿栓をせずに 3 本毎にアルミホイルで巻いて滅菌缶につめた。 ③180℃で 4 時間乾熱滅菌した。 ○ゲル作製用三角フラスコ、メスシリンダー ①ブラッシングにより洗浄後、水洗いし、蒸留水で軽くリンスした。 ②乾燥後、口に 7cm 四方程度のアルミホイルで蓋をした。 ④ そのまま 180 度/Over Night にて乾熱滅菌を行った。 132 三重大学大学院 工学研究科 B-4. 本研究で使用した試薬について <FBS の不活化・分注・保存> ① -20℃にて凍結保存されている FBS(500ml)を 37℃のウォーターバスに浸け、振 り混ぜながら溶かした。 ② 完全に溶かし終えたら、数回振り混ぜた。 ③ 55~56℃のウォーターバスで 30 分加熱した。 ④ STERICUPTM にてフィルター滅菌し、50ml 遠心管に 40ml ずつ分注した。作業 はクリーンベンチ内、滅菌操作で行った。 ⑤ -20℃の冷凍庫にて保存した。 <ITS> ITS(粉末状)の瓶に DEPC 処理水 50ml を入れ、攪拌、溶解させたものを分注した。 <HC> HC の粉末 2mg を量り取り、無水 EtOH と DEPC 処理水をそれぞれ 1ml ずつ加え て溶解させたものを MILLEX®GP にて濾過、分注した。 <DEPC 処理水の作製> ① Milli-Q 水を密閉できるガラス瓶(青蓋の 500ml メディウムビン)に入れた。 ② 500ml の Milli-Q 水に対し DEPC を 500μl(0.1%)加えて、蓋をきっちり閉めてよ く振り混ぜた。 ※DEPC は発癌性があるため、この作業は全てドラフト内で行うこと。 ③ そのまま 37℃のオーブン内に入れ、2 時間加温した。30 分に一度振り混ぜた。 ※ 振り混ぜることで瓶の蓋や首の部分、液体内に DEPC が均一に広がり、全 体の RNase を失活させる。 ④ 瓶の蓋を十分緩めて、121℃/40 分(1 分あたり 500ml の場合)高圧蒸気滅菌に かけた。 ※高圧蒸気滅菌をすることにより DEPC を除去する。滅菌後にも DEPC の臭いが残 っている場合は、もう一度高圧蒸気滅菌を行う。 ※DEPC は発癌性であるため、むやみに蒸気を吸わないように気を付けること。また、 滅菌装置内に溜まった水は、気化して抜けた DEPC が溶け込んでいるため、その 排水は責任をもって処理すること(大量の水と共に排水口へ)。 133 三重大学大学院 工学研究科 <Random Primers、各 Primer について> これらの Stock Solution(S.S)は粉末状の試薬に DEPC 処理水を適宜加えて作成 した。詳細は添付の取扱説明書に従った。 <滅菌水の作製> ① 脱イオン水を密閉できるガラス瓶(赤蓋の 1L メディウムビン)に入れた。 ② 蓋をきっちり閉めた後、滅菌テープで封印し、121℃/40 分にて高圧蒸気滅菌を 行った。 134 三重大学大学院 工学研究科 C -1. 腹膜透析排液サンプル結果まとめ (#1~#) 2010/5/18 B(1) #2 2010/5/25 C(1) #3 24 man 69 2010/6/1 C(2) #4 2010/6/8 C(3) #5 2010/6/22 #6 4 man 62 2010/6/29 E(1) #7 2010/6/29 #8 41 man 82 2010/7/6 A(2) #9 2 man 82 2010/7/27 H(1) #10 C,Eの患者他界 #1 man 76 ① 患者イニシャル・・・ A, B, C, E, H, N, O, Q, R, S, T, U, V, W, X, Y, Z(17人) 2010/5/11 A(1) 11 2013/2/6 現在 Initial man 82 ① 採取日 性別 年齢 39 1 1423 -90 94 1565 52 428 1110 -403 57 1771 258 33 2072 357 0 1700 ① 133 1379 -336 1 1700 ① 16 9 9 16 ○ 56% 10 22 ○ 2% 99% 14(P3) ○ 38% 98% ○(P3) 99% 0 1500 1776 1500 65 1772 259 ① ① 0 1483 -30 ②+Icodextrin CAPD期間 (month) 0 238 ① 透析液 腹膜炎(回) 使用透析液量(ml) 1500 1642 129 × +/- 未 #7,#24,#25#32(イコデキストリン) #5,12,13,16,21,24,25,27,29,30,31,32,33,34,37,40,41,42,43,45,46(血性排液) 14 ○ 63% 99% 12 140 10 ○ 17 ○ +/- 94% 1700 2084 369 24 +/- 備考 135 総重量(g) 除水量(g) 細胞総数 (x 10⁴cells) 接着細胞率 増殖日数 (days) P0 Cytokeratin-18 P1 P2 P0 α-SMA P1 P2 P0 TER値(Ω・cm²) P1 P2 タンパク抽出 × P0 P1 増殖定数k(day⁻¹) P2 P3 Desmin P2 Vimentin P2 SA-β-Gal P0 ①Baxter ダイアニール N PD-2 1.5 透析液 ②Baxter ダイアニール N PD-2 2.5 ③Baxter エクストラニール 三重大学大学院 工学研究科 年齢 性別 Initial 42 82 man 2010/8/3 A(3) #11 0 ① 3 82 man 2010/8/17 H(2) #12 1 ① 27 69 man 2010/8/31 C(4) #13 1 ① 43 82 man 2010/9/28 A(4) #14 0 ① 16 76 man 2010/10/5 B(2) #15 0 ① 37 49 man 2010/10/19 N(1) #16 1 ① 45 82 man 2010/10/26 A(5) #17 0 ① 17 76 man 2010/11/9 B(3) #18 0 ① 38 49 man 2010/11/16 N(2) #19 ① 46 82 man 2010/11/30 A(6) #20 136 採取日 CAPD期間 (month) 0 ① 2465 447 透析液 腹膜炎(回) 2500 2924 401 1 2000 1500 1603 90 使用透析液量(ml) 2000 2131 113 1700 2412 697 2500 2759 236 1500 1775 262 1500 1475 -38 7465 23 5.34% 26 未 0.160 0.068 18% 9% 513 0.99% 13 ○ 0.255 0.278 0.092 0.002 9% 363 0.58% 20 1500 1790 277 17 871 0.40% 6039 10 106 0.59% 24 17 25% 41% 14 22 23 ○ 0.302 0.270 0.169 0.088 52% 1700 1929 214 26 99% 98% 16% 20% ○ 0.279 0.395 0.266 96% 総重量(g) 除水量(g) 12 99% 91% 27% 22% 96% 85% 28% 2% 22 22 ○ 0.442 0.221 0.390 0.118 99% 99% 細胞総数 (x 10⁴cells) 18 100% 37% ○ 0.074 16 20 ○ 0.249 0.206 0.034 0.053 ○ 0.152 0.186 0.006 不可 130 1.53% 22 100% 99% 98% 45% 9% 48% 不可 48 0.76% 接着細胞率 増殖日数 (days) P0 Cytokeratin-18 P1 P2 100% 99% P0 α-SMA P1 P2 70% 72% P0 TER値(Ω・cm²) P1 P2 21 タンパク抽出 ○ ○ P0 P1 0.162 増殖定数k(day⁻¹) P2 P3 Desmin P2 Vimentin P2 SA-β-Gal P0 φ 35シャーレがコンフルエントになる日数 増殖日数 排液密度 1.009g/ml 三重大学大学院 工学研究科 使用透析液量(ml) 総重量(g) 除水量(g) 透析液 腹膜炎(回) CAPD期間 (month) 性別 年齢 Initial 2500 2618 95 0 ① 39 man 49 2010/12/7 N(3) #21 1500 1535 22 0 ① 76 18 man 2010/12/14 B(4) #22 2000 2305 287 1 ① 48 man 82 2011/1/18 A(7) #23 1500 2983 1470 0 ③ 40 man 49 2011/1/25 N(4) #24 1500 2790 1276 0 ③ 41 man 49 2011/2/8 N(5) #25 2000 2426 408 1 ① 49 man 82 2011/2/15 A(8) #26 1500 1612 98 0 ① 20 man 76 2011/2/22 B(5) #27 2000 2601 583 0 ① 21 man 76 2011/3/15 B(6) #28 397 1500 1646 132 1 ① 51 man 82 2011/4/12 A(9) #29 1500 1507 -6.5 1 ① 22 man 76 2011/4/19 B(7) #30 137 採取日 細胞総数 (x 10⁴cells) 96 1.20% 21 13 100% 99% 32 0.97% 30 100% 59% ○(P1,P2) 100% 139 27.00% 8 100% 9% 0% ○ ○ 0.160 0.177 0.001 ○(P1) 0.266 0.352 0.141 25% 20% 67 1.36% 28 接着細胞率 増殖日数 (days) 89% 35% ○(P1) 0.148 0.300 18% 2137 4.00% 22 98% 97% 99% ○ 0.185 0.070 0.032 86% 9% 33% 58% 1197 0.54% 6 100% 100% 21 43% 33% 23 ○(P1,P2) 0.219 0.344 -0.016 ○(P1) 0.217 0.216 54% 88% 34 0.79% 23 99% 68% ○ 0.087 0.159 0.122 0.384 105 2.45% 9 P0 P1 P2 P0 P1 P2 P0 P1 P2 P0 P1 P2 P3 P2 P2 P0 1863 4.91% 3 Cytokeratin-18 α-SMA TER値(Ω・cm²) タンパク抽出 増殖定数k(day⁻¹) Desmin Vimentin SA-β-Gal 三重大学大学院 工学研究科 woman 68 23 man 76 44 man 49 53 man 82 2011/6/7 A(10) #35 0 ① 13 man 83 H(3) #36 0 ① 45 man 49 N(7) #37 0 ① 24 man 76 2011/6/21 B(9) #38 1 ① 53 man 82 2011/6/28 A(11) #39 1 ① 46 man 49 2011/7/12 N(8) #40 #34 O(1) 20 1 ① #33 woman 68 0 ① #32 Initial 20 0 ① 2500 3288 766 #31 性別 年齢 0 ③ 31 1500 1617 104 100% 100% 52 0.59% 1500 1701 188 100% 100% 95 11.73% 8 1500 1367 -146 100% 100% 8 1605 1500 2464 950 100% 100% 56 8.12% 13 1500 1494 -20 100% 8 33.97% 27 1500 1948 434 1498 0.07% 9 2500 2694 172 2011/6/14 CAPD期間 (month) 0 ① 126 1500 1413 -100 100% 2011/5/24 B(8) N(6) 透析液 腹膜炎(回) 1500 1524 10 2011/5/17 O(2) 使用透析液量(ml) 総重量(g) 除水量(g) 100% 16 19% 29 22 1% 22 ○ 0.396 0.33 0.0235 9% 3% 19 20 0.059 0.181 0.146 0.053 23% 6% 21 24 0.151 0.367 -0.032 0.244 9% 17% 19 25 0.439 0.289 0.118 7% 36% 26 23 0.1439 0.4 0.1439 0.225 5% 27% 27 25 0.167 0.22 9% 30% 0.306 0.525 0.254 16% 138 採取日 細胞総数 (x 10⁴cells) 2297 0.02% P0 P1 P2 P0 P1 P2 P0 P1 P2 P0 P1 P2 P3 P2 P2 P0 217 0.33% 13 接着細胞率 増殖日数 (days) Cytokeratin-18 α-SMA TER値(Ω・cm²) タンパク抽出 増殖定数k(day⁻¹) Desmin Vimentin SA-β-Gal 三重大学大学院 工学研究科 透析液 腹膜炎(回) CAPD期間 (month) 性別 年齢 Initial 1500 1141 -373 0 ③ 14 man 83 2011/7/19 H(4) #41 1498 2500 2924 402 1 ① 47 man 49 2011/8/9 N(9) #42 1923 2500 2768 246 1 ① ? woman 50 2011/8/30 N(10) #43 18 1500 1801 288 1 ① 16 man 83 2011/9/13 H(5) #44 159 1500 1621 108 0 ① 27 man 76 2011/9/27 B(10) #45 572 ? 2454 ? 1 ? 49 man 50 2011/10/4 N(11) #46 17 1500 1760 247 1 ① 57 man 83 2011/10/11 A(12) #47 100 1500 1595 81.5 1 ① 28 man 77 2011/10/25 B(11) #48 1730 2500 2392 -130.5 1 ① 50 man 50 2011/11/1 N(12) #49 33 1500 1670 156.5 1 ① 58 man 83 2011/11/8 A(13) #50 14 98% 100% 16 34% 20% ○ 139 採取日 使用透析液量(ml) 総重量(g) 除水量(g) 13 99% 98% 0% 37% 100% 細胞総数 (x 10⁴cells) 100% 100% 13% 0% 21 22% 18% 100% 15 99% 14 100% 99% 44% ○ 50% EVOM故障により測定不可 ○ 28% 19 ○ 57% 21 ○ 89% 22 27% ○ 16% ○ 47% ○ 5% 2% 21 19 ○ 0.248 0.14 0.332 20% ○ 12 P0 P1 P2 P0 P1 P2 P0 P1 P2 P0 P1 P2 P3 P2 P2 P0 157 3.85% 接着細胞率 増殖日数 (days) Cytokeratin-18 α-SMA TER値(Ω・cm²) タンパク抽出 増殖定数k(day⁻¹) Desmin Vimentin SA-β-Gal 三重大学大学院 工学研究科 使用透析液量(ml) 透析液 腹膜炎(回) CAPD期間 (month) 性別 年齢 Initial 1500 1573 59.5 1 ① 29 man 77 2011/11/22 B(12) #51 2500 2684 161.5 1 ① 50 man 50 2011/11/29 N(13) #52 1500 2751 1237.5 1 ① 50 woman 50 2011/11/29 N(14) #53 1500 1748 234.5 1 ① 59 man 83 2011/12/6 A(14) #54 1500 1558 44.5 1 ① 30 man 77 2011/12/20 B(13) #55 1500 1802 288.5 不明 ① 不明 不明 不明 2012/1/17 不明 #56 1500 1520 6.5 1 ① 31 man 77 2012/1/24 B(14) #57 1500 1572 58.5 1 ① 34 man 77 2012/4/24 B(15) #58 69 2.79% 1500 1761 247.5 不明 ① 64 man 83 2012/5/8 A(15) #59 4221 500 405 -99.5 1 woman 68 2012/5/25 Q(1) #60 18.3 38% 20 23% 36% 7% 8% 2% 140 採取日 総重量(g) 除水量(g) 40 2.04% ○ 41% 78% 45 ○ 69% 85% 19 × 27% 100% 50 100% 100% 20 99% 659 100% 100% 20% 2558 98% 32% 18% ○ 51% 24.3 29% EVOM故障により測定不可 16% 35% 44 P0 P1 P2 P0 P1 P2 P0 P1 P2 P0 P1 P2 P3 P2 P2 P0 細胞総数 (x 10⁴cells) 接着細胞率 増殖日数 (days) Cytokeratin-18 α-SMA TER値(Ω・cm²) タンパク抽出 増殖定数k(day⁻¹) Desmin Vimentin SA-β-Gal 三重大学大学院 工学研究科 性別 Initial 71 man 2012/5/28 R(1) #61 77 man B(16) #62 68 woman 2012/5/29 Q(2) #63 71 man R(2) #64 75 man S(1) #65 68 woman 2012/6/5 Q(3) #66 71 man R(3) #67 ① 65 83 man 2012/6/12 A(16) #68 ① 2 71 man 2012/6/13 R(4) #69 2 68 woman 2012/6/19 Q(4) #70 採取日 年齢 2 ① ① 1000 936 -73 2 1500 1272 -241.5 2100 ① 1500 1759 245.5 491 36 1500 1632 118.5 69 1 1000 948 -61 187 1 1500 1395 -118.5 746 35 500 668 163.5 251 1 750 767 10.25 1185 1 1500 1563 49.5 746 0.65% ① 500 509 4.5 92 1.15% 6% 7% 100% 6116 0.30% 11% 13% 93% 7% 10% 98% 5% 9% 10% 89% 12% 4% 10% 8% 100% 93% CAPD期間 (month) 透析液 腹膜炎(回) 使用透析液量(ml) P0 P1 P2 P0 P1 P2 P0 P1 P2 P0 P1 P2 P3 P2 P2 P0 141 総重量(g) 除水量(g) 細胞総数 (x 10⁴cells) 接着細胞率 増殖日数 (days) Cytokeratin-18 α-SMA TER値(Ω・cm²) タンパク抽出 増殖定数k(day⁻¹) Desmin Vimentin SA-β-Gal 三重大学大学院 工学研究科 man 84 man 77 man 84 5 man 71 2012/8/7 A(18) 0 2012/7/10 A(17) T(2) 0 2012/7/6 T(1) 0 1500 1790 276 2012/8/28 B(18) 33 1500 1796 282 176 1500 1484 -30 2011/9/11 A(19) R(7) #80 man 71 ① 0 1500 1427 -86.5 #79 #73 man 84 68 616 1500 1826 312.5 #78 #72 2012/6/26 B(17) man 71 ① #77 #71 R(6) man 77 38 #76 2012/6/19 R(5) man 71 67 #75 Initial man 71 1 #74 性別 年齢 66 採取日 CAPD期間 (month) 1 45 1597 36 2806 1538 2 3706 1212 2 透析液 腹膜炎(回) P0 P1 P2 P0 P1 P2 P0 P1 P2 P0 P1 P2 P3 P2 P2 P0 142 使用透析液量(ml) 総重量(g) 除水量(g) 細胞総数 (x 10⁴cells) 接着細胞率 増殖日数 (days) Cytokeratin-18 α-SMA TER値(Ω・cm²) タンパク抽出 増殖定数k(day⁻¹) Desmin Vimentin SA-β-Gal 三重大学大学院 工学研究科 70 man 84 3 man 41 #90 man 78 #89 41 73 1500 1699 186 #88 man 78 1500 1698 185 #87 40 106 #86 1 man 73 1500 1626 113 #85 5 man 71 639 #84 #82 2 man 42 42 1500 1350 -164 #83 #81 man 83 78 1500 1280 -234 採取日 2012/9/25 B(19) 69 271 1500 1400 -114 2012/11/13 A(21) U(3) man 77 55 1500 1781 268 2012/11/6 B(21) 2011/9/18 U(1) 39 40 1500 1752 239 2012/10/30 V(1) B(20) Initial 1 man 41 1500 1562 49 2012/10/10 R(8) 性別 年齢 79 2012/10/9 A(20) U(2) CAPD期間 (month) 60 1500 1629 116 143 透析液 腹膜炎(回) 使用透析液量(ml) 総重量(g) 除水量(g) P0 P1 P2 P0 P1 P2 P0 P1 P2 P0 P1 P2 P3 P2 P2 P0 細胞総数 (x 10⁴cells) 接着細胞率 増殖日数 (days) Cytokeratin-18 α-SMA TER値(Ω・cm²) タンパク抽出 増殖定数k(day⁻¹) Desmin Vimentin SA-β-Gal 三重大学大学院 工学研究科 12 man 59 1500 1493 -21 72 man 84 2013/1/23 A(23) #97 280 2000 1890 -128 5 man 41 U(4) #98 263 1500 1519 6 43 man 78 2013/1/29 B(25) #99 219 2058 13 man 59 W(2) #100 2 2000 2151 133 1 man 34 X(1) #101 308 1434 1 man 77 2013/2/5 Y(1) #102 41 1546 1 man 76 Z(1) #103 CAPD期間 (month) 透析液 腹膜炎(回) 2012/12/25 B(24) W(1) #96 #94 man 78 1902 195 #95 #93 2012/12/11 A(22) 42 245 #92 2012/11/27 B(23) man 84 1500 1564 50 #91 man 78 71 579 2012/11/14 T or R B(22) 41 83 1500 1718 205 Initial man 78 1500 1547 33 採取日 41 133 man 71 209 1500 1636 122 性別 年齢 1500 1528 15 ① 230 P0 P1 P2 P3 P2 P2 P0 144 ② 使用透析液量(ml) 総重量(g) 除水量(g) P0 P1 P2 P0 P1 P2 P0 P1 P2 細胞総数 (x 10⁴cells) 接着細胞率 増殖日数 (days) Cytokeratin-18 α-SMA TER値(Ω・cm²) タンパク抽出 増殖定数k(day⁻¹) Desmin Vimentin SA-β-Gal 三重大学大学院 工学研究科