Transcript
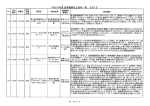
~ 旧法下において 旧法下 において取得 において 取得した 取得 した承認及 した 承認及び 承認及 び 届出品目の 届出品目 の 改正後における 改正後 における取 における 取 り 扱 い に ついて~ ついて ~ 旧法下- 旧法下-承認品目 旧法 改正後 H17.7/7 クラスⅡ基準なし クラスⅢ クラスⅣ <一変同時提出><提出期限> 薬食発第 0707005 号 記載整備 H18.6/8 承認 薬食発第 0608003 号 認証移行 クラスⅡ(JIS 以外) クラスⅢ、Ⅳ <提出書類> (確認認証) 確認認証) クラスⅡ 基準あり 旧法上 H16. 7/9 H17.3/31 承認 薬食発第 0709004 号-第5,11 薬食発第 0331002 号-第2,7 1.認証申請書(H17.3/31 薬食機 0331008 号) 2.添付すべき資料 ①規格への適合宣言 ②適合性認証基準に適合することを証明する資料 ③表示物(ラベルの写し) ④旧法における承認書の写し ⑤製造又は輸入の実績を示す資料(旧法 GMP(又は GMPI)での記録の写し) ⑥旧法での業許可証の品目一覧の写し ⑦添付資料の変更部分 一部変更認 証申請書 同時提出 可能 旧法での製造業/ 輸入販売業許可 の有効期間内 ※認証申請の際、GMP 適合性調査が必要。 製造販売届 出し直し クラスⅠ クラスが下がったものについては 承認整理を行う。 承認整理 旧法下- 旧法下-届出品目 旧法 改正後 H18.4/25 薬食発第 0425006 号 H18. 6/8 薬食発第 0608001 号 クラスⅡ 基準なし 承認移行 (確認承認) 確認承認) <提出書類> <一変同時提出><提出期限> 1.承認申請書(H18.6/8 薬食機 0608001 号) 2.添付すべき資料 ①旧法での許可証の写し ②一括して申請する場合は、当該申請に係る品目の一覧表 ③表示物(ラベルの写し)、添付文書 ④製造又は輸入の実績を示す資料(旧法 GMP(又は GMPI)での記録の写し) ⑤製造販売業の許可証の写し(又はハガキ) 一部変更承 認申請書 同時提出 不可 旧法での製造業/ 輸入販売業許可 の有効期間内 または H20 年 3 月末日 の いずれか早い方 ※QMS省令による査察は行わない 。 ※一法人同時申請のこと。(複数回に分けて申請できない) H18.6/8 薬食発第 0608003 号 認証移行 届出 (確認認証) 確認認証) クラスⅠ クラスⅡ(JIS) クラスⅡ 基準あり H16. 7/9 H17.3/31 クラスⅠ ※その他関連通知 – 旧法上 届出 薬食発第 0709004 号-第5,11 薬食発第 0331002 号-第2,7 製造販売届 出し直し 1.認証申請書(H17.3/31 薬食機 0331008 号) 2.添付すべき資料 ①規格への適合宣言 ②適合性認証基準に適合することを証明する資料 ③表示物(ラベルの写し) ④製造又は輸入の実績を示す資料(旧法 GMP(又は GMPI)での記録の写し) ⑤旧法での業許可証の品目一覧の写し ⑥旧法で製造/輸入していた品目であることを確認するための資料 (製造標準書のうち該当箇所を抜粋した資料、添付文書 or 取扱説明書) ⑦添付資料の変更部分 旧法での製造業/ 輸入販売業許可 の有効期間内 ※認証申請の際、GMP 適合性調査が必要。 H18.6/30 事務連絡「旧法の規定に基づき製造又は輸入していた医療用具の新法に係る取扱い等に関する Q&A について(その 1)」 Expartner Japan